Kierownik
Prof. dr hab. n. med. Agata Adamczyk tel. 22 608 65 72, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.; pokój C-204
Sekretariat
Dorota Rycko tel. 48-22-60-86-613, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.; pokój C-209
Pracownicy naukowi
prof. dr hab. n. med. Joanna B. Strosznajder, tel.22 608 64 14, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr hab. n. med. Grzegorz A. Czapski, tel.22 608 66 00, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr hab. n. med. Magdalena Gąssowska-Dobrowolska, tel.22 608 64 20, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Anna Wilkaniec, tel.22 608 66 00, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Magdalena Cieślik, tel.22 608 64 20, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Ewelina Pałasz, tel.22 608 64 20, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Gabriela Olech-Kochańczyk, tel.22 608 64 20, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr inż. Ewelina Bielska, tel.22 608 64 13 Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Pracownicy naukowo-techniczni
mgr Elżbieta Gawinek, tel. 22 608 64 13, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Post-doc
dr Piotr Wójcik, tel. 22 608 64 13 Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Doktoranci
mgr inż. Marta Matuszewska, tel.22 6086413 Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr inż. Agnieszka Banaszek tel.22 6086413, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Profil badawczy
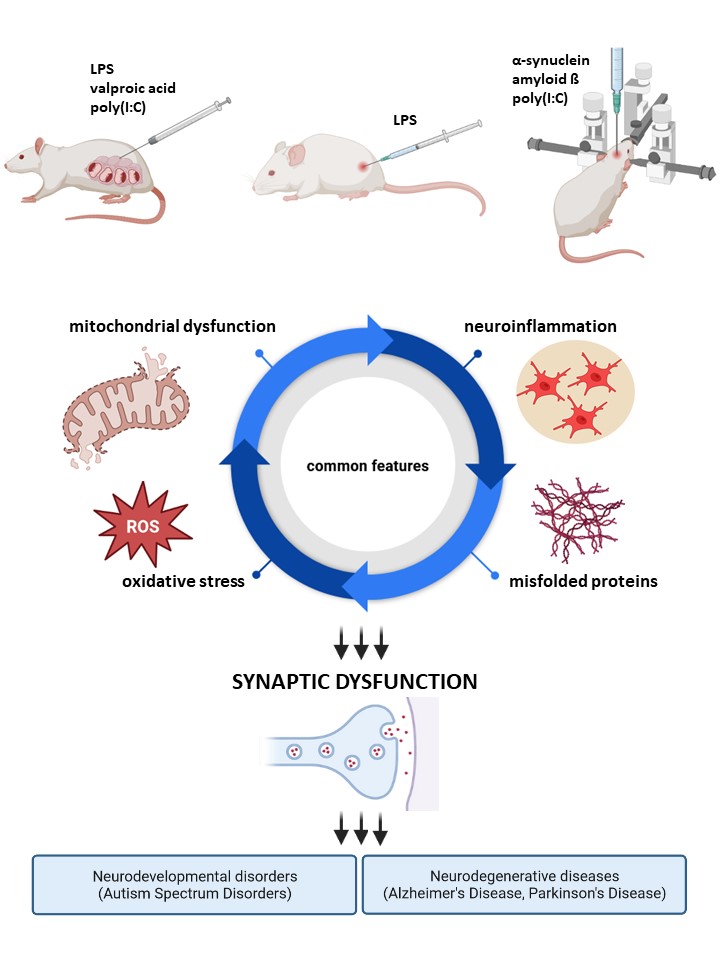
Zagadnienia badawcze Zakładu koncentrują się na molekularnych mechanizmach odpowiedzialnych za rozwój zaburzeń neurorozwojowych i chorób neurodegeneracyjnych, w tym choroby Parkinsona i Alzheimera. Są to schorzenia uwarunkowane wieloczynnikowo, w patomechanizmie których istotny udział może mieć nadmierna aktywacja układu odpornościowego oraz białka o zaburzonej konformacji: α-synukleina (α-syn) i amyloid beta (Aβ). W szczególności koncentrujemy się na wyjaśnieniu zależności pomiędzy tymi czynnikami, a aktywacją komórek gleju i związanym z tym stresem oksydacyjnym oraz dysfunkcją mitochondriów, co może stanowić wspólne podłoże patologii synaps w rozwijającym się i w dojrzałym mózgu. Badania są prowadzone we współpracy z wieloma ośrodkami krajowymi i zagranicznymi, z wykorzystaniem nowoczesnych technik badawczych oraz licznych modeli eksperymentalnych o różnym poziomie złożoności, od pojedynczych komórek poprzez hodowle organotypowe in vitro i modele zwierzęce, do analizy materiału pochodzącego od pacjentów. Naszym nadrzędnym celem jest wyznaczenie nowych punktów uchwytu dla potencjalnych leków oraz zwiększenie możliwości działań terapeutycznych w chorobach ośrodkowego układu nerwowego związanych z zaburzeniami funkcjonowania synaps.
Granty
Rola receptora purynergicznego P2X7 w wywoływaniu zaburzeń metabolicznych w mózgu i w neurodegeneracji w mysim modelu choroby Parkinsona. NCN, SONATA BIS 13, 2023/50/E/NZ4/00550, 2024-2029; kierownik - dr Anna Wilkaniec
Mechanizmy zależnej od uszkodzenia mitochondriów aktywacji układu immunologicznego w eksperymentalnych modelach choroby Parkinsona. Rola zaburzeń funkcji Parkiny. NCN, OPUS 20 LAP, 2020/39/I/NZ4/01031, 2021-2026; kierownik – prof. dr hab. Agata Adamczyk
Wpływ wysiłku fizycznego na poziom czynników neurotroficznych z rodziny CDNF/MANF w mysim modelu choroby Parkinsona indukowanym domózgowym podaniem oligomerów alfa-synukleiny. NCN, MINIATURA 4, 2020/04/X/NZ4/00773, 2022-2023, kierownik - dr Ewelina Pałasz;
Rola zależnej od ATP aktywacji receptorów purynergicznych P2 w zaburzeniach energetycznych w mózgu w zwierzęcym modelu autyzmu. NCN, PRELUDIUM 20, 2021/41/N/NZ4/02350, 2022-2025; kierownik grantu - mgr inż. Lidia Babiec;
Nowa rola receptora alfa aktywowanego przez proliferatory peroksysomów w regulacji metabolizmu peptydów beta amyloidu i funkcji mitochondriów w zwierzęcym modelu choroby Alzheimera. NCN Preludium 2019/35/N/NZ4/03706, 2020-2023; kierownik - dr Sylwia Wójtowicz
Rola białek z rodziny BET w regulacji zależnych od komórek mikrogleju procesów neurodegeneracji - znaczenie w patomechanizmach choroby Alzheimera. NCN OPUS 2018/31/B/NZ4/01379, 2019-2023; kierownik – dr hab. Grzegorz A. Czapski
Znaczenie zaburzeń sygnalizacji zależnej od receptorów zewnątrzkomórkowych nukleozydów i nukleotydów w dysfunkcji synaps w autyzmie. NCN OPUS 2017/25/B/NZ4/01969, 2018-2022; kierownik – dr hab. Agata Adamczyk
Wpływ prenatalnej aktywacji układu immunologicznego na funkcje mitochondriów. NCN SONATA 2016/23/D/NZ4/03572, 2017-2021; kierownik - dr Magdalena Cieślik
Wyjaśnienie molekularnych mechanizmów leżących u podłoża połączenia jelito-mózg w zaburzeniach ze spektrum autyzmu. Zbadanie roli probiotyków w leczeniu autyzmu. SymbioPharm GmbH, Niemcy; 2018-2019; kierownik – dr hab. Agata Adamczyk,
Znaczenie kinazy sfingozyny 1 oraz sfingozyno-1-fosforanu w doświadczalnym modelu choroby Parkinsona oraz w farmakologicznej cytoprotekcji. NCN, Etiuda 4, 2016/20/T/NZ3/00504, 2016-2017; kierownik – dr Joanna A. Motyl
Znaczenie polimerazy poli(AP-rybozy) i sirtuin w regulacji śmierci komórek. Nowe punkty uchwytu w terapii choroby Alzheimera. NCN, OPUS, 2013/09//B/NZ3/01350, 2014-2017; kierownik - prof. Joanna B. Strosznajder
Udział receptorów purynergicznych P2 w dysfunkcji mitochondriów wywołanej alfa-synukleiną. Znaczenie w chorobie Parkinsona. NCN, 2013/009/D/NZ3/01359, 2014-2016; kierownik - dr Anna Wilkaniec
Rola ścieżki sygnalizacyjnej z udziałem receptorów dla sfingo-1 fosforanu (S1P) w zwierzęcym modelu choroby Parkinsona. Poszukiwanie nowych punktów uchwytu w planowaniu strategii terapeutycznych. NCN, 2013/09/N/Nz4/02045, 2014-2016; kierownik – mgr Joanna A. Pyszko
Udział Parkiny w molekularnych mechanizmach śmierci komórek wywołanej egzogenną alfa-synukleiną. Znaczenie w chorobie Parkinsona i innych synukleinopatiach. NCN, 2012/05/B/NZ3/02047, 2012-2016; kierownik - dr hab. Agata Adamczyk
Współpraca krajowa
- Warszawski Uniwersytet Medyczny; Wydział Farmaceutyczny; Zakład Farmakodynamiki - prof. dr hab. Magdalena Bujalska-Zadrożny;
- Instytut Biologii Doświadczalnej im. Marcelego Nenckiego PAN, Pracownia Metod Behawioralnych - dr Paweł Boguszewski;
- Instytut Biologii Doświadczalnej im. Marcelego Nenckiego PAN, Pracownia Molekularnych Podstaw Ruchów Komórkowych - dr hab. Krzysztof Nieznański;
- Poradnia Schorzeń Pozapiramidowych CSK MSWiA - lek. med. Kamila Bojakowska;
- Wydział Chemii Uniwersytetu Warszawskiego, Pracownia Elektrochemii – dr Marcin Strawski
- Pomorski Uniwersytet Medyczny w Szczecinie, Katedra i Zakład Biochemii i Chemii Medycznej – prof. dr hab. Irena Baranowska-Bosiacka;
- Uniwersytet Medyczny w Białymstoku - prof. dr hab. n. med. Barbara Mroczko;
Współpraca zagraniczna
- Institute of Pharmacology and Clinical Pharmacy, Biochemical and Pharmacological Center, Marburg, Germany - Prof. Carsten Culmsee;
- Louisiana State University Health Sciences Center, Department of Neurology, New Orleans, USA - Prof. Walter J. Lukiw;
- University of Missouri – Columbia (MU), Thompson Center For Autism & Neurodevelopmental Disorders, Missouri, USA - Prof. David Q. Beversdorf;
- University of Missouri, Department of Biochemistry, Columbia, USA – Prof. Grace Y. Sun;
- Institute for Pharmacy and Biochemistry, Pharmacology and Toxicology, Johannes-Gutenberg University Mainz, Mainz, Germany - Prof. Kristina Friedland;
Aparatura
- Aparatura naukowo-badawcza do analizy komórek metodą cytometrii przepływowej Becton Dickinson FACS Canto II;
- Czytnik mikropłytek Thermo Scientific Multiscan GO;
- Spektrofotometr Nanodrop 2000;
- Spektrofotometr Shimadzu UV-1700;
- Termocykler Perkin–Elmer GeneAmp PCR System 2400;
- Termocykler Eppendorf Mastercycler;
- Mikroskop fluorescencyjny odwrócony OLYMPUS IX-71;
- Licznik scyntylacyjny Wallac 1409;
- Ultrawirówka Backman LE-70;
- Aparat stereotaktyczny dla małych zwierząt RWD Life Science
- System do anestezji z niskimi przepływami SomnoSuite
Metody badawcze
- analiza zachowania myszy i szczurów w testach behawioralnych: test otwartego pola, test rozpoznawania nowego obiektu, trzykomorowy test zachowań socjalnych Crawley’a, test wokalizacji ultradźwiękowej, test podwieszonego labiryntu krzyżowego, test Rotarod, test siły uchwytu, test słupa
- hodowla komórek i bakterii in vitro
- analiza morfometryczna neurytów w komórkach in vitro
- analiza przeżywalności i obumierania komórek in vitro metodami: MTT, LDH i po barwieniu błękitem trypanu i jodkiem propidyny
- analiza apoptotycznej kondensacji chromatyny w komórkach in vitro metodą Hoechst 33342
- analiza poziomu stresu oksydacyjnego w komórkach in vitro i w mitochondriach przy użyciu sond fluorescencyjnych DCF, DAF-2 i MitoSOX
- analiza potencjału błony mitochondrialnej w komórkach in vitro metodą JC-1
- analiza poziomu ATP w komórkach in vitro metodą bioluminescencyjną
- analiza poziomu glutationu i aktywności enzymów stanu redoks metodą spektrofotometryczną
- analiza peroksydacji lipidów i oksydacji białek metodą spektrofotometryczną (TBARS, DNPH)
- analiza napływu wapnia do komórek metodą radioizotopową i FLUO-4
- oznaczanie aktywności enzymów metodą radioizotopową, spektrofotometryczną i fluorescencyjną
- analiza immunoreaktywności białek metodami Western blot, ELISA, LUMINEX, antibody array
- analiza modyfikacji potranslacyjnych białek metodą immunoprecypitacji i Western blottingu (ubikwitynacja, fosforylacja, S-nitrozylacja, poli(ADP-rybozyl)acja)
- analiza stabilności cytoszkieletu metodą elektroforetyczną z immunodetekcją α/β-tubuliny metodą Western blot
- immunohistochemia
- cytometria przepływowa
- izolacja kwasów nukleinowych (DNA, RNA, miRNA)
- analiza poziomu mRNA i miRNA metodami RT-PCR, qPCR, gene expression arrays
- analiza polimorfizmu genów metodą PCR i RFLP
- wyciszanie genów in vitro metodą siRNA
- transfekowanie komórek in vitro metodą elektroporacji i lipofekcji
- transformacja bakterii w obecności jonów Ca2+
- obrazowanie w mikroskopie fluorescencyjnym i konfokalnym komórek i tkanek
- analiza migracji komórek „scratch assay”
- analiza fagocytozy komórek z użyciem fluorescencyjnych mikrosfer
Modele badawcze in vitro:
- hodowle pierwotne neuronów kory mózgowej szczura;
- linia neuronopodobnych komórek wywodzących się z ludzkiej neuroblastomy SH-SY5Y;
- linia unieśmiertelnionych komórek ludzkiego mikrogleju C20
- ludzkie komórki śródmózgowia linii LUHMES
- linia neuronopodobnych komórek wywodzących się ze szczurzej pheochromocytomy PC12;
- linia unieśmiertelnionych neuronów z hipokampa myszy HT22;
- linia unieśmiertelnionych komórek mikrogleju myszy BV2;
- linia transfekowanych komórek PC12 cechujących się trwałą ekspresją ludzkiego genu białka prekursorowego amyloidu beta (APP) typu dzikiego;
- linia transfekowanych komórek PC12 cechujących się trwałą ekspresją ludzkiego genu białka prekursorowego amyloidu beta (APP) z podwójną mutacją szwedzką (K670M/N671L);
- linia transfekowanych komórek PC12 cechujących się trwałą ekspresją ludzkiego genu α-synukleiny (SNCA);
- linia transfekowanych komórek PC12 cechujących się trwałą ekspresją ludzkiego genu parkiny (PRKN);
Modele badawcze in vivo:
- mysi model choroby Alzheimera polegający na dokomorowym podaniu oligomerów Aβ, pozwalający na badanie ostrych efektów toksyczności Aβ;
- mysi model choroby Parkinsona polegający na podaniu α-synukleiny do prążkowia;
- model ogólnoustrojowej aktywacji układu odpornościowego u myszy i szczura polegający na dootrzewnowym podaniu lipopolisacharydu (LPS);
- szczurzy model autyzmu polegający na prenatalnej ekspozycji na kwas walproinowy (VPA) – dootrzewnowa iniekcja VPA w 12,5 dniu ciąży, badania prowadzone są na zwierzętach potomnych;
- szczurzy model zaburzeń neurorozwojowych polegający na prenatalnej ekspozycji na aktywację układu immunologicznego matki – dootrzewnowa iniekcja LPS w 9,5 dniu ciąży, badania prowadzone są na zwierzętach potomnych (model MIA - ang. Maternal Immune Activation);
- mysi model zaburzeń neurorozwojowych polegający na prenatalnej ekspozycji na aktywację układu immunologicznego matki – dootrzewnowa iniekcja kwasu poliinozyno-policytydylowego w 17 dniu ciąży, badania prowadzone są na zwierzętach potomnych (model MIA);
- myszy, u których metodą knock-outu genetycznego wyeliminowano gen parkiny; szczep B6.129S4-Prkntm1Shn/J
- myszy z nadekspresją parkiny; szczep B6;FVB-Tg(Prnp-PARK2)196Kfw/EkraJ
Wybrane publikacje
Bielska E, Matuszewska M, Wojcik P, Wilkaniec A, Cieślik M, Gąssowska-Dobrowolska M, Sulejczak D, Czapski G A, Adamczyk A, Tau Hypophosphorylation at Ser416 as the Early Molecular Imprint of Maternal Immune Activation: Insights from Female Mice Offspring Int. J. Mol. Sci. 2025, 26, 10778 https://doi.org/10.3389/fnmol.2025.1619583
Matuszewska M, Wilkaniec A, Gąssowska-Dobrowolska M, Cieślik M, Olech-Kochańczyk G, Pałasz E, Gawinek E, Strawski M, Czapski G A Inhibition of BET proteins modulates amyloid-beta accumulation and cognitive performance in middle-aged mice prenatally exposed to maternal immune activation. Front. Mol. Neurosci., 14 July 2025 Volume 18 - 2025
Matuszewska M, Wilkaniec A, Cieślik M, Strawski M, Czapski G. A. The Inhibition of Bromodomain and Extraterminal Domain (BET) Proteins Protects Against Microglia-Mediated Neuronal Loss In Vitro. Biomolecules 2025 Apr 4;15(4):528. doi: 10.3390/biom15040528.
Babiec L., Wilkaniec A., Gawinek E., Hilgier W., Adamczyk A. Inhibition of purinergic P2 receptors prevents synaptic and behavioral alterations in a rodent model of autism spectrum disorders. Research in Autism Spectrum Disorders 2024, 112, 102353; https://doi.org/10.1016/j.rasd.2024.10235
Czapski GA, Matuszewska M, Cieślik M, Strosznajder JB. Inhibitor of bromodomain and extraterminal domain proteins decreases transcription of Cd33 in the brain of mice subjected to systemic inflammation; a promising strategy for neuroprotection. Folia Neuropathol. 2024;62(2):127-135. doi: 10.5114/fn.2024.138140
Ruiz-Ortega ED, Wilkaniec A, Adamczyk A. Liquid-liquid phase separation and conformational strains of α-Synuclein: implications for Parkinson's disease pathogenesis. Front Mol Neurosci. 2024 Oct 23;17:1494218. doi: 10.3389/fnmol.2024.1494218. PMID: 39507104; PMCID: PMC11537881
Gąssowska-Dobrowolska M, Olech-Kochańczyk G, Culmsee C, Adamczyk A. Novel Insights into Parkin-Mediated Mitochondrial Dysfunction and "Mito-Inflammation" in α-Synuclein Toxicity. The Role of the cGAS-STING Signalling Pathway. J Inflamm Res. 2024 Jul 11;17:4549-4574. doi: 10.2147/JIR.S468609. PMID: 39011416; PMCID: PMC11249072.
Żulińska S, Strosznajder AK, Strosznajder JB. Current View on PPAR-α and Its Relation to Neurosteroids in Alzheimer's Disease and Other Neuropsychiatric Disorders: Promising Targets in a Therapeutic Strategy. Int J Mol Sci. 2024 Jun 28;25(13):7106. doi: 10.3390/ijms25137106. PMID: 39000217; PMCID: PMC11241121
Żulińska S, Wencel PL, Czubowicz K, Strosznajder JB. Alterations in mRNA level of proteins related to redox state and mitochondria in Alzheimer’s disease animal model: Promising targets in neuroprotection Folia Neuropathol. 2024;62(3):237-247. doi: 10.5114/fn.2024.143039. PMID: 39529534
Babiec L, Wilkaniec A, Gawinek E, Hilgier W, Adamczyk A. Inhibition of purinergic P2 receptors prevents synaptic and behavioral alterations in a rodent model of autism spectrum disorders. Elsevier. Research in Autism Spectrum Disorders 112, 2024, 102353
Gąssowska-Dobrowolska M, Czapski GA, Cieślik M, Zajdel K, Frontczak-Baniewicz M, Babiec L, Adamczyk A. Microtubule Cytoskeletal Network Alterations in a Transgenic Model of Tuberous Sclerosis Complex: Relevance to Autism Spectrum Disorders. Int. J. Mol. Sci. 2023, 24, 7303. https://doi.org/10.3390/ijms24087303
Cieślik M, Zawadzka A, Czapski GA , Wilkaniec A, Adamczyk A. Developmental Stage-Dependent Changes in Mitochondrial Function in the Brain of Offspring Following Prenatal Maternal Immune Activation. Int. J. Mol. Sci. 2023, 24, 7243. https://doi.org/10.3390/ijms24087243
Palasz E, Wilkaniec A, Stanaszek L, Andrzejewska A, Adamczyk A. Glia-Neurotrophic Factor Relationships: Possible Role in Pathobiology of Neuroinflammation-Related Brain Disorders. Int J Mol Sci. 2023, 24, 6321. https://doi.org/10.3390/ijms24076321
Gąssowska-Dobrowolska M, Kolasa A, Beversdorf DQ, Adamczyk A. Alterations in Cerebellar Microtubule Cytoskeletal Network in a ValproicAcid-Induced Rat Model of Autism Spectrum Disorders. Biomedicines. 2022 Nov 24;10(12):3031. doi: 10.3390/biomedicines10123031. PMID: 36551785; PMCID: PMC9776106.
Matuszewska M, Cieślik M, Wilkaniec A, Strawski M, Czapski GA. The Role of Bromodomain and Extraterminal (BET) Proteins in Controlling the Phagocytic Activity of Microglia In Vitro: Relevance to Alzheimer's Disease. Int J Mol Sci. 2022 Dec 20;24(1):13. doi: 10.3390/ijms24010013. PMID: 36613460; PMCID: PMC9820364.
Cieślik M, Gassowska-Dobrowolska M, Zawadzka A, Frontczak-Baniewicz M, Gewartowska M, Dominiak A, Czapski GA, Adamczyk A. The Synaptic Dysregulation in Adolescent Rats Exposed to Maternal Immune Activation. Front Mol Neurosci. 2021 Jan 14;13:555290. doi: 10.3389/fnmol.2020.555290. PMID: 33519375; PMCID: PMC7840660.
Gąssowska-Dobrowolska M, Kolasa-Wołosiuk A, Cieślik M, Dominiak A, Friedland K, Adamczyk A. Alterations in Tau Protein Level and Phosphorylation State in the Brain of the Autistic-Like Rats Induced by Prenatal Exposure to Valproic Acid. Int J Mol Sci. 2021 Mar 22;22(6):3209. doi: 10.3390/ijms22063209. PMID: 33809910; PMCID: PMC8004207.
Sun GY, Appenteng MK, Li R, Woo T, Yang B, Qin C, Pan M, Cieślik M, Cui J, Fritsche KL, Gu Z, Will M, Beversdorf D, Adamczyk A, Han X, Greenlief CM. Docosahexaenoic Acid (DHA) Supplementation Alters Phospholipid Species and Lipid Peroxidation Products in Adult Mouse Brain, Heart, and Plasma. Neuromolecular Med. 2021 Mar;23(1):118-129. doi: 10.1007/s12017-020-08616-0. Epub 2020 Sep 14. PMID: 32926329; PMCID: PMC9555299.
Strosznajder AK, Wójtowicz S, Jeżyna MJ, Sun GY, Strosznajder JB. Recent Insights on the Role of PPAR-β/δ in Neuroinflammation and Neurodegeneration, and Its Potential Target for Therapy. Neuromolecular Med. 2021 Mar;23(1):86-98. doi: 10.1007/s12017-020-08629-9. Epub 2020 Nov 18. PMID: 33210212; PMCID: PMC7929960.
Motyl JA, Strosznajder JB, Wencel A, Strosznajder RP. Recent Insights into the Interplay of Alpha-Synuclein and Sphingolipid Signaling in Parkinson's Disease. Int J Mol Sci. 2021 Jun 11;22(12):6277. doi: 10.3390/ijms22126277. PMID: 34207975; PMCID: PMC8230587.
Jęśko H, Wieczorek I, Wencel PL, Gąssowska-Dobrowolska M, Lukiw WJ, Strosznajder RP. Age-Related Transcriptional Deregulation of Genes Coding Synaptic Proteins in Alzheimer's Disease Murine Model: Potential Neuroprotective Effect of Fingolimod. Front Mol Neurosci. 2021 Jul 9;14:660104. doi: 10.3389/fnmol.2021.660104. PMID: 34305524; PMCID: PMC8299068.
Wilkaniec A, Lenkiewicz AM, Babiec L, Murawska E, Jęśko HM, Cieślik M, Culmsee C, Adamczyk A. Exogenous Alpha-Synuclein Evoked Parkin Downregulation Promotes Mitochondrial Dysfunction in Neuronal Cells. Implications for Parkinson's Disease Pathology. Front Aging Neurosci. 2021 Feb 24;13:591475. doi: 10.3389/fnagi.2021.591475. PMID: 33716707; PMCID: PMC7943853.
Czapski GA, Babiec L, Jęśko H, Gąssowska-Dobrowolska M, Cieślik M, Matuszewska M, Frontczak-Baniewicz M, Zajdel K, Adamczyk A. Synaptic Alterations in a Transgenic Model of Tuberous Sclerosis Complex: Relevance to Autism Spectrum Disorders. Int J Mol Sci. 2021 Sep 17;22(18):10058. doi: 10.3390/ijms221810058. PMID: 34576223; PMCID: PMC8466868.
Czapski GA, Strosznajder JB. Glutamate and GABA in Microglia-Neuron Cross-Talk in Alzheimer's Disease. Int J Mol Sci. 2021 Oct 28;22(21):11677. doi: 10.3390/ijms222111677. PMID: 34769106; PMCID: PMC8584169.
Zawadzka A, Cieślik M, Adamczyk A. The Role of Maternal Immune Activation in the Pathogenesis of Autism: A Review of the Evidence, Proposed Mechanisms and Implications for Treatment. Int J Mol Sci. 2021 Oct 26;22(21):11516. doi: 10.3390/ijms222111516. PMID: 34768946; PMCID: PMC8584025.
Czapski GA, Cieślik M, Białopiotrowicz E, Lukiw WJ, Strosznajder JB. Down-regulation of cyclin D2 in amyloid β toxicity, inflammation, and Alzheimer's disease. PLoS One. 2021 Nov 18;16(11):e0259740. doi: 10.1371/journal.pone.0259740. PMID: 34793515; PMCID: PMC8601534.
Gąssowska-Dobrowolska M, Cieślik M, Czapski GA, Jęśko H, Frontczak-Baniewicz M, Gewartowska M, Dominiak A, Polowy R, Filipkowski RK, Babiec L, Adamczyk A. Prenatal Exposure to Valproic Acid Affects Microglia and Synaptic Ultrastructure in a Brain-Region-Specific Manner in Young-Adult Male Rats: Relevance to Autism Spectrum Disorders. Int J Mol Sci. 2020 May 18;21(10):3576. doi: 10.3390/ijms21103576. PMID: 32443651; PMCID: PMC7279050.
Jęśko H, Cieślik M, Gromadzka G, Adamczyk A. Dysfunctional proteins in neuropsychiatric disorders: From neurodegeneration to autism spectrum disorders. Neurochem Int. 2020 Dec;141:104853. doi: 10.1016/j.neuint.2020.104853. Epub 2020 Sep 24. PMID: 32980494.
Wilkaniec A, Cieślik M, Murawska E, Babiec L, Gąssowska-Dobrowolska M, Pałasz E, Jęśko H, Adamczyk A. P2X7 Receptor is Involved in Mitochondrial Dysfunction Induced by Extracellular Alpha Synuclein in Neuroblastoma SH-SY5Y Cells. Int J Mol Sci. 2020 May 31;21(11):3959. doi: 10.3390/ijms21113959. PMID: 32486485; PMCID: PMC7312811.
Cieślik M, Czapski GA, Wójtowicz S, Wieczorek I, Wencel PL, Strosznajder RP, Jaber V, Lukiw WJ, Strosznajder JB. Alterations of Transcription of Genes Coding Anti-oxidative and Mitochondria-Related Proteins in Amyloid β Toxicity: Relevance to Alzheimer's Disease. Mol Neurobiol. 2020 Mar;57(3):1374-1388. doi: 10.1007/s12035-019-01819-y. Epub 2019 Nov 16. PMID: 31734880; PMCID: PMC7061023.
Cieślik M, Gąssowska-Dobrowolska M, Jęśko H, Czapski GA, Wilkaniec A, Zawadzka A, Dominiak A, Polowy R, Filipkowski RK, Boguszewski PM, Gewartowska M, Frontczak-Baniewicz M, Sun GY, Beversdorf DQ, Adamczyk A. Maternal Immune Activation Induces Neuroinflammation and Cortical Synaptic Deficits in the Adolescent Rat Offspring. Int J Mol Sci. 2020 Jun 8;21(11):4097. doi: 10.3390/ijms21114097. PMID: 32521803; PMCID: PMC7312084.
Jęśko H, Wencel PL, Wójtowicz S, Strosznajder J, Lukiw WJ, Strosznajder RP. Fingolimod Affects Transcription of Genes Encoding Enzymes of Ceramide Metabolism in Animal Model of Alzheimer's Disease. Mol Neurobiol. 2020 Jun;57(6):2799-2811. doi: 10.1007/s12035-020-01908-3. Epub 2020 Apr 30. PMID: 32356173; PMCID: PMC7253528.
Wilkaniec A, Lenkiewicz AM, Czapski GA, Jęśko HM, Hilgier W, Brodzik R, Gąssowska-Dobrowolska M, Culmsee C, Adamczyk A. Extracellular Alpha-Synuclein Oligomers Induce Parkin S-Nitrosylation: Relevance to Sporadic Parkinson's Disease Etiopathology. Mol Neurobiol. 2019 Jan;56(1):125-140. doi: 10.1007/s12035-018-1082-0. Epub 2018 Apr 21. PMID: 29681024; PMCID: PMC6334739.
Ganjam GK, Bolte K, Matschke LA, Neitemeier S, Dolga AM, Höllerhage M, Höglinger GU, Adamczyk A, Decher N, Oertel WH, Culmsee C. Mitochondrial damage by α-synuclein causes cell death in human dopaminergic neurons. Cell Death Dis. 2019 Nov 14;10(11):865. doi: 10.1038/s41419-019-2091-2. PMID: 31727879; PMCID: PMC6856124.
Jęśko H, Lukiw WJ, Wilkaniec A, Cieślik M, Gąssowska-Dobrowolska M, Murawska E, Hilgier W, Adamczyk A. Altered Expression of Urea Cycle Enzymes in Amyloid-β Protein Precursor Overexpressing PC12 Cells and in Sporadic Alzheimer's Disease Brain. J Alzheimers Dis. 2018;62(1):279-291. doi: 10.3233/JAD-170427. PMID: 29439324.
Wilkaniec A, Gąssowska-Dobrowolska M, Strawski M, Adamczyk A, Czapski GA. Inhibition of cyclin-dependent kinase 5 affects early neuroinflammatory signalling in murine model of amyloid beta toxicity. J Neuroinflammation. 2018 Jan 4;15(1):1. doi: 10.1186/s12974-017-1027-y. PMID: 29301548; PMCID: PMC5753486.
Wilkaniec A, Gąssowska M, Czapski GA, Cieślik M, Sulkowski G, Adamczyk A. P2X7 receptor-pannexin 1 interaction mediates extracellular alpha-synuclein-induced ATP release in neuroblastoma SH-SY5Y cells. Purinergic Signal. 2017 Sep;13(3):347-361. doi: 10.1007/s11302-017-9567-2. Epub 2017 May 17. PMID: 28516276; PMCID: PMC5563296.
Czapski GA, Cieślik M, Wencel PL, Wójtowicz S, Strosznajder RP, Strosznajder JB. Inhibition of poly(ADP-ribose) polymerase-1 alters expression of mitochondria-related genes in PC12 cells: relevance to mitochondrial homeostasis in neurodegenerative disorders. Biochim Biophys Acta Mol Cell Res. 2018 Feb;1865(2):281-288. doi: 10.1016/j.bbamcr.2017.11.003. Epub 2017 Nov 8. PMID: 29128369.
Jęśko H, Wencel P, Strosznajder RP, Strosznajder JB. Sirtuins and Their Roles in Brain Aging and Neurodegenerative Disorders. Neurochem Res. 2017 Mar;42(3):876-890. doi: 10.1007/s11064-016-2110-y. Epub 2016 Nov 24. PMID: 27882448; PMCID: PMC5357501.
Jęśko H, Lenkiewicz AM, Adamczyk A. Treatments and compositions targeting α-synuclein: a patent review (2010-2016). Expert Opin Ther Pat. 2017 Apr;27(4):427-438. doi: 10.1080/13543776.2017.1261112. Epub 2016 Nov 23. PMID: 27841042.
Czapski GA, Gąssowska M, Wilkaniec A, Chalimoniuk M, Strosznajder JB, Adamczyk A. The mechanisms regulating cyclin-dependent kinase 5 in hippocampus during systemic inflammatory response: The effect on inflammatory gene expression. Neurochem Int. 2016 Feb;93:103-12. doi: 10.1016/j.neuint.2016.01.005. Epub 2016 Jan 21. PMID: 26806339.
Czapski GA, Czubowicz K, Strosznajder JB, Strosznajder RP. The Lipoxygenases: Their Regulation and Implication in Alzheimer's Disease. Neurochem Res. 2016 Feb;41(1-2):243-57. doi: 10.1007/s11064-015-1776-x. Epub 2015 Dec 16. PMID: 26677076; PMCID: PMC4773476.
Gąssowska M, Baranowska-Bosiacka I, Moczydłowska J, Tarnowski M, Pilutin A, Gutowska I, Strużyńska L, Chlubek D, Adamczyk A. Perinatal exposure to lead (Pb) promotes Tau phosphorylation in the rat brain in a GSK-3β and CDK5 dependent manner: Relevance to neurological disorders. Toxicology. 2016 Mar 10;347-349:17-28. doi: 10.1016/j.tox.2016.03.002. Epub 2016 Mar 21. PMID: 27012722.
Jęśko H, Wilkaniec A, Cieślik M, Hilgier W, Gąssowska M, Lukiw WJ, Adamczyk A. Altered Arginine Metabolism in Cells Transfected with Human Wild-Type Beta Amyloid Precursor Protein (βAPP). Curr Alzheimer Res. 2016;13(9):1030-9. doi: 10.2174/1567205013666160314150348. PMID: 26971935.
Gąssowska M, Baranowska-Bosiacka I, Moczydłowska J, Frontczak-Baniewicz M, Gewartowska M, Strużyńska L, Gutowska I, Chlubek D, Adamczyk A. Perinatal exposure to lead (Pb) induces ultrastructural and molecular alterations in synapses of rat offspring. Toxicology. 2016 Dec 12;373:13-29. doi: 10.1016/j.tox.2016.10.014. Epub 2016 Oct 29. PMID: 27974193.
Wilkaniec A, Czapski GA, Adamczyk A. Cdk5 at crossroads of protein oligomerization in neurodegenerative diseases: facts and hypotheses. J Neurochem. 2016 Jan;136(2):222-33. doi: 10.1111/jnc.13365. Epub 2015 Oct 14. PMID: 26376455.