Kierownik
Prof. dr hab. n. med. Magdalena Zielińska, tel. 22 60 86 470, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript. ; pokój C-202
Sekretariat
Dorota Rycko, tel. 22 60 86 417, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript. ; pokój C-222; C-209
Pracownicy naukowi
prof. dr hab. Jan Albrecht, tel. 22 60 86 617, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr hab. Monika Szeliga, prof. IMDiK, tel. 22 60 86 416, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Marta Obara – Michlewska, tel. 22 60 86 416, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Mariusz Popek, tel. 22 60 86 442, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Daniel Kalinowski, tel. 22 60 86 416, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Karolina Orzeł-Gajowik, tel. 22 60 86 442, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Marius Bidon, tel. 22 60 86 416, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Pracownicy naukowo-techniczni
mgr Małgorzata Bogacińska-Karaś, tel. 22 60 86 440; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr Kamila Szumska, tel. 22 60 86 417; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Doktoranci
mgr Zuzanna Sulej tel. 22 60 86 442; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr Subati Saimaiti tel. 22 60 86 442; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Absolwenci i byli pracownicy
dr Anna Czarnecka
dr Marek Pawlik
dr Krzysztof Milewski
dr Katarzyna Skowrońska
dr inż. Ewelina Majewska
dr inż. Katarzyna Dąbrowska
mgr Aleksandra Nakonieczna UW
inż. Katarzyna Serafin PW
inż. Karolina Strzelczyk PW
inż. Julia Urbanek PW
inż. Aleksandra Mróz PW
licencjat Wiktoria Pietrowicz SGGW
Profil badawczy
- Mechanizmy komórkowe i molekularne leżące u podłoża encefalopatii wątrobowej (EW).
- Współdziałanie astrocytów, neuronów i komórek śródbłonka naczyń mózgowych w powstawaniu obrzęku mózgu towarzyszącego EW.
- Rola stresu oksydacyjnego i nitracyjnego (SON): udział glutaminy i amoniaku w indukcji SON.
- Rola sygnalizacji komórkowej związanej z cyklicznym GMP i kanałów jonowych.
- Glutamina a fenotyp glejaków złośliwych: udział glutaminaz.
- Rola glutaminy w patomechanizmie padaczki skroniowej.
Granty
- Investigating the Role of GLS2 in the Mitotic Progression of Glioblastoma Cells. Projekt finansowany z Funduszu Badań Własnych, kierownik projektu: dr Marius Bidon (2025-2026)
- Metaboliczny fenotyp wewnątrzwątrobowej cholestazy ciężarnych. - grant MINIATURA 9 nr 2025/09/X/NZ7/00454 Narodowego Centrum Nauki, kierownik projektu: dr Karolina Orzeł-Gajowik (2025-2026)
- Nowa perspektywa udziału mitochondriów w rozwoju cytotoksycznego obrzęku mózgu w ostrej niewydolności wątroby - grant SONATA 19 nr 2023/51/D/NZ5/02035 Narodowego Centrum Nauki, kierownik projektu: dr Mariusz Popek (2024-2027)
- Znaczenie sygnalizacji estrogenowego receptora β w neuronach korowych w warunkach stresu — rola miRNA - grant MINIATURA 8 nr 2024/08/X/NZ5/00349 Narodowego Centrum Nauki, kierownik projektu: dr Daniel Kalinowski (2024-2025)
- Zależność alprazolamu w ujęciu sygnalizacji estrogenowej w modelu myszy z przewlekłym stresem. Projekt finansowany z Funduszu Badań Własnych, kierownik projektu: dr Daniel Kalinowski (2024-2025)
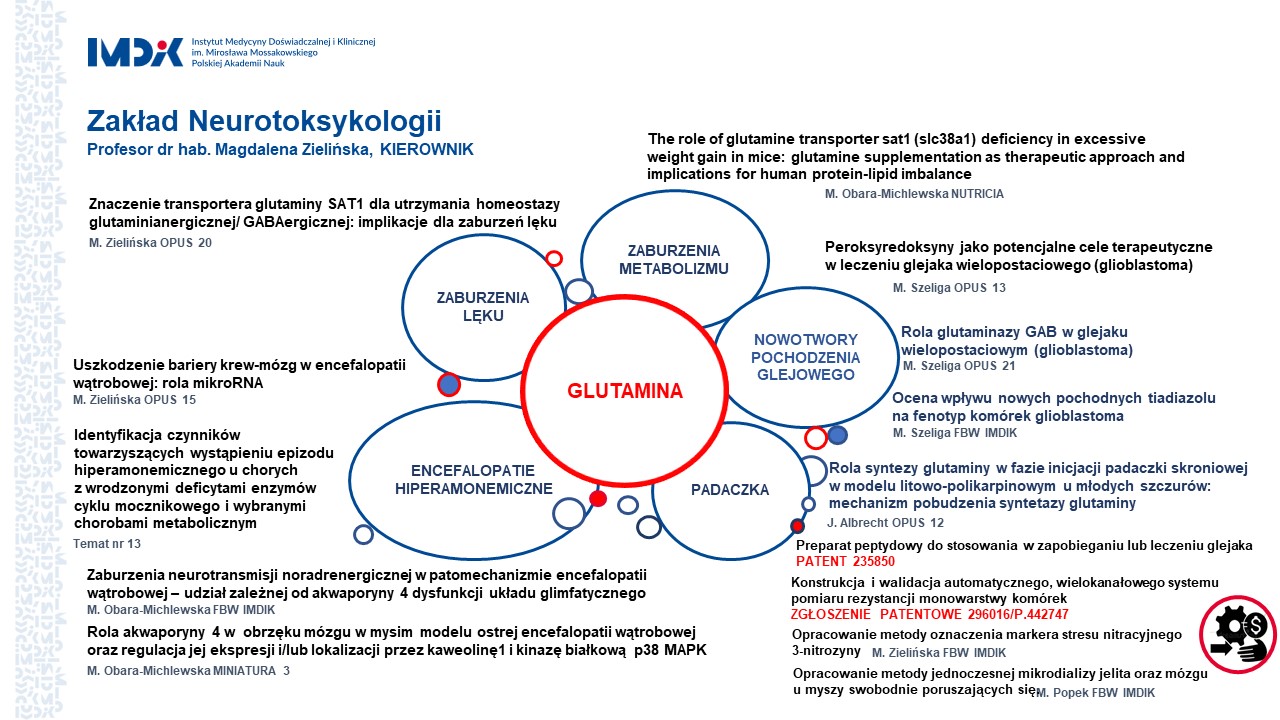
- Zaburzenia neurotransmisji noradrenergicznej w patomechanizmie encefalopatii wątrobowej – udział zależnej od akwaporyny 4 dysfunkcji układu glimfatycznego. Projekt finansowany z Funduszu Badań Własnych, kierownik projektu: dr Marta Obara-Michlewska (2023-2024)
- Konstrukcja i walidacja automatycznego, wielokanałowego systemu pomiaru rezystancji monowarstwy komórek. Projekt finansowany z Funduszu Badań Własnych, kierownik projektu: mgr Karolina Orzeł-Gajowik (2022-2023)
- Rola glutaminazy GAB w glejaku wielopostaciowym (glioblastoma); grant OPUS 21 nr 2021/41B/NZ5/01883 Narodowego Centrum Nauki, kierownik projektu: dr hab. Monika Szeliga (2021-2025)
- Znaczenie transportera glutaminy SAT1 dla utrzymania homeostazy glutaminianergicznej/ GABAergicznej: implikacje dla zaburzeń lęku. grant OPUS 20 nr 2020/39/B/NZ5/01962 Narodowego Centrum Nauki, kierownik projektu: prof. dr hab. Magdalena Zielińska , (2021 - 2026)
- The role of glutamine transporter sat1 (slc38a1) deficiency in excessive weight gain in mice –glutamine supplementation as therapeutic approach and implications for human protein-lipid imbalance; Projekt Fundacji NUTRICIA nr RG 3/2020, kierownik projektu: dr Marta Obara-Michlewska (2020-2022)
- Ocena wpływu nowych pochodnych tiadiazolu na fenotyp komórek glioblastoma. Projekt finansowany z Funduszu Badań Własnych, kierownik projektu: dr hab. Monika Szeliga (2021-2022)
- Opracowanie metody oznaczenia markera stresu nitracyjnego -3-nitrozyny. Projekt finansowany z Funduszu Badań Własnych; kierownik projektu: prof. dr hab. Magdalena Zielińska (2021-2022)
- Opracowanie metody jednoczesnej mikrodializy jelita oraz mózgu u myszy swobodnie poruszających się. Projekt finansowany z Funduszu Badań Własnych, kierownik projektu: dr Mariusz Popek (2021-2022)
- Rola akwaporyny 4 w obrzęku mózgu w mysim modelu ostrej encefalopatii wątrobowej oraz regulacja jej taffsji i/lub lokalizacji przez kaweolinę1 i kinazę białkową p38 MAPK; grant MINIATURA 3 nr 2019/03/X/NZ4/00623 Narodowego Centrum Nauki, kierownik: dr Marta Obara-Michlewska (2019-2020)
- Rola astrocytarnych receptorów NMDA w regulacji aktywności syntetazy glutaminy w hodowanych astrocytach mysich. Próba zdefiniowania wewnątrzastrocytarnych szlaków sygnałowych; grant PRELUDIUM 14 nr 2017/27/N/NZ3/02819 Narodowego Centrum Nauki, kierownik: mgr Katarzyna Skowrońska (2018-2020)
- Peroksyredoksyny jako potencjalne cele terapeutyczne w leczeniu glejaka wielopostaciowego (glioblastoma), grant OPUS 13 nr 2017/25/B/NZ7/00388 Narodowego Centrum Nauki, kierownik: dr Monika Szeliga (2018-2023)
- Rola syntezy glutaminy w fazie inicjacji padaczki skroniowej w modelu litowo-polikarpinowym u młodych szczurów: mechanizm pobudzenia syntetazy glutaminy ; grant OPUS 12 nr 2016/23/B/NZ4/03678 Narodowego Centrum Nauki, kierownik: prof. dr hab. Jan Albrecht (2017-2022)
- Uszkodzenie bariery krew-mózg w encefalopatii wątrobowej: rola mikroRNA; grant OPUS 10 nr 2015/19/B/NZ4/01902 Narodowego Centrum Nauki, kierownik: dr hab. Magdalena Zielińska (2016-2022)
- Udział czynnika transkrypcyjnego SP1 w regulacji ekspresji astrocytarnego transportera glutaminy SN1 : wpływ jonów amonowych i interakcji astrocyt-neuron; grant PRELUDIUM 11, nr 2016/21/N/NZ4/03759 Narodowego Centrum Nauki kierownik: mgr inż. Katarzyna Dąbrowska (2017-2020)
- Szlak sygnałowy związany z kinazą białkową B w komórkach glioblastoma transfekowanych glutaminazą typu wątrobowego (gab), grant PRELUDIUM 12 nr 2016/23/N/NZ5/01428 Narodowego Centrum Nauki, kierownik: mgr inż. Ewelina Majewska (2017-2019)
- Receptor farnezylowy X w mózgu – nowy element w patomechanizmie ostrej encefalopatii wątrobowej , grant MINIATURA1 nr 2017/01/X/NZ4/00110 Narodowego Centrum Nauki, kierownik: dr Anna Czarnecka (2017-2018)
- Zmiany w składzie białkowym i własnościach elektrofizjologicznych synapsy glutamatergicznej w mysim modelu ostrej encefalopatii wątrobowej: rola tkankowego czynnika wzrostu β1 (TGF β1) , grant PRELUDIUM 10 nr 2015/19/N/NZ5/02249 Narodowego Centrum Nauki, kierownik: mgr inż. Mariusz Popek (2016-2019)
- Regulacja ekspresji astrocytarnej glutaminazy przez czynniki zapalne w encefalopatii wątrobowej, grant PRELUDIUM nr 2014/15/N/NZ5/03634 Narodowego Centrum Nauki, kierownik: projektu mgr Krzysztof Milewski (2015 – 2017)
- Rola mózgowej asymetrycznej dwumetyloargininy (ADMA)w encefalopatii wątrobowej: marker, mediator czy regulator? Grant OPUS nr 2013/09/B/NZ4/00536 Narodowego Centrum Nauki, kierownik: dr hab. Magdalena Zielińska (2014-2017)
- Nowe pochodne 1,3,4-thiadiazoli jako inhibitory kluczowych etapów cyklu glutamina-glutaminian w komórkach glioblastoma, grant SONATA nr 2013/11/D/NZ7/00925, Narodowego Centrum Nauki, kierownik: dr Monika Szeliga (2014-2017)
- Udział transportu glutaminazy w pojawianiu się obrzęku mózgu i zaburzeń funkcji synapsy glutaminianergicznej związanych z encefalopatią wątrobową, grant nr Pol-Nor/196190/26/2013, Narodowego Centrum Badań i Rozwoju w ramach Programu Polsko-Norweskiej Współpracy Badawczej “CORE”, kierownik: prof. dr hab. Jan Albrecht (2013-2016)
- Rola astrocytarnych receptorów NMDA w hiperamonemicznym obrzęku mózgu towarzyszącym encefalopatii wątrobowej, grant HARMONIA nr 2013/08/M/NZ3/00869 Narodowego Centrum Nauki, kierownik: prof. dr hab. Jan Albrecht (2013-2016)
Współpraca krajowa
- Instytut Pomnik-Centrum Zdrowia Dziecka w Warszawie (dr Dariusz Rokicki)
- Uniwersytet Medyczny w Lublinie (prof. Waldemar A. Turski)
- Uniwersytet Medyczny w Lublinie (prof. Stanisław Czuczwar)
- Instytut Farmakologii im. Jerzego Maja Polskiej Akademii Nauk w Krakowie (prof. Grzegorz Hess)
- Uniwersytet Medyczny w Lublinie; Katedra i Klinika Neurochirurgii i Neurochirurgii Dziecięcej (prof. Radosław Rola)
- Uniwersytet Warmińsko-Mazurski; Wydział Lekarski, Katedra Kardiologii i Chorób Wewnętrznych (dr hab. n. med. Jarosław Ćwikła)
Współpraca zagraniczna
- Faculty of Life Science, University of Manchester, UK (prof. Alexei Verkhratsky)
- The Biotechnology Centre of Oslo, University of Oslo, Norway (prof. Farrukh A. Chaudhry)
- Faculty of Sciences, University of Málaga, Spain (prof. Javier Marquez)
- Department of Drug Design and Pharmacology, Faculty of Health and Medical Sciences, University of Copenhagen, Denmark (Prof. Helle S. Waagepetersen, Dr. Blanca I. Aldana)
Aparatura
- urządzenie IDEXX Catalyst One do analizy biochemicznej wybranych parametrów pełnej krwi, osocza lub surowicy
- zestaw do HPLC firmy Dionex z detektorem fluorescencyjnym, elektrochemicznym, autosamplerem i termostatem kolumn
- termocykler Biometra, 3 bloki (48 miejsc w każdym bloku)
- czytnik ELISA (Micrplate Reader – płytki 96-dołkowe) Bio-Rad; filtry: 415, 450, 480, 570, 595, 655, 750 nm i płytką do oznaczania kwasów nukleinowych
- aparat do dokumentacji i analizy materiałów znakowanych chemiluminescencyjnie (med. Western-blot), fluorescencyjnie (med. bromek etydyny) i kolorymetrycznie, G-Box firmy Syngene
- aparat stereotaktyczny firmy Stoelting CO
- zestaw do mikrodializy wolnobiegających małych zwierząt laboratoryjnych
- system do perfuzji ciągłej skrawków model 745
- aparat Brandel przystosowany do badań izolowanych preparatów (skrawki) i na hodowlach komórkowych
- aparat do transfekcji komórek Lonza
- mikroskop fluorescencyjny JuLI
- zestaw Pinnacle 8400 do rejestracji EEG, EMG oraz obrazu u wolno-biegających myszy lub szczurów
Metody badawcze
Biochemiczne/ molekularne:
- metody radioizotopowe: analiza transportu znakowanych aminokwasów; wiązania radioligandów receptorów
- pomiar generacji wtórnych przekaźników (cykliczny AMP, cykliczny GMP), oznaczanie ilościowe aminokwasów, ich pochodnych, innych związków z wykorzystaniem chromatografii; ocena aktywności enzymatycznej metodami kolorymetrycznymi, immonoenzymatycznymi (ELISA), cytometria przepływowa
- hodowle pierwotne komórek układu nerwowego; hodowle komórek ludzkich; hodowle linii komórkowych ze stabilną ekspresją genów kodujących wybrane białka; klonowanie; transfekcja
- techniki immunocytochemii, immunohistochemii do wizualizacji morfologicznej oraz jakościowej analizy wybranych białek; fluorescencyjna analiza mikroskopowa
- genotypowanie zwierząt techniką klasycznego PCR; ilościowe oznaczenia ekspresji mRNA (Real Time PCR); białka (Western Blot); frakcjonowanie białek błonowych i wewnątrzkomórkowych
Behawioralne:
- testy: poziom lęku (uniesiony labirynt krzyżowy), zachowania depresyjne (FST); sensomotoryczne (spontaniczna ruchliwość (OF, RotaRod, Griptest); basen Morrisa
- modele: ostrej encefalopatii wątrobowej; podwiązania dróg żółciowych (BDL); hiperamonemii prostej; litowo-pilokarpinowy model padaczki skroniowej u szczura; stresu unieruchomienia
- instrumentalne: implantacja stereotaktyczna kaniuli do określonych miejsc kory mózgowej (PFC) i podawania związków; izolacja struktur mózgowych; perfuzja-dializa mózgowa małych zwierząt laboratoryjnych (wolno-biegających oraz w narkozie).
Patenty
tytuł: Preparat peptydowy do stosowania w zapobieganiu lub leczeniu glejaka. numer patentu: 235850; data ogłoszenia: 2020-04-08
autorzy: Szeliga Monika, Lipkowski Andrzej, Różycki Krzysztof
Wybrane publikacje
- Popek M, Goryca K, Adamska D, Urban-Ciećko J, Hryniewiecka K, Lipiec M, Krawczyk TG, Rafalko K, Ławicka A, Liddelow SA, Szewczyk LM. Astrocytic TCF7L2 Impacts Brain Osmoregulation and Restricts Neuronal Excitability. Glia. 2026 Feb;74(2):e70103. doi: 10.1002/glia.70103.
- Biegański M, Bidon M, Karpińska M, Rola R, Matysiak J, Niewiadomy A, Szeliga M. 1,2,4-triazole incorporated into polyheterocyclic scaffolds as anti-glioblastoma agents: Biological evaluation and molecular modeling studies. Comput Biol Chem. 2025 Nov 10;120(Pt 1):108771. doi: 10.1016/j.compbiolchem.2025.108771. Online ahead of print.
- Aleksandrowicz M, Wencel M, Kciuk M, Popek M, Przykaza Ł. Effect of experimental hypoosmolar hyponatremia on the blood brain barrier and brain edema formation, Sci Rep. 2025 Jul 2;15(1):23361. doi: 10.1038/s41598-025-06320-2.
-
Martyna Nalepa, Omar Basheer, Mariusz Radkiewicz, Katarzyna Skowrońska, Aleksandra Skweres, Aleksandra Owczarek, Agata Dalka, Wojciech Hilgier, Magdalena Zielińska, Emilia Samborowska, Michał Węgrzynowicz, Loss of arginase 2 disrupts striatum-specific polyamine homeostasis. FEBS, 2025, Oct. 31 https://doi.org/10.1111/febs.70313
-
Kalinowski D., Zielińska M. Prediction of microRNAs targeting oestrogen receptor beta: implications for emotional disorders.Neuroscience. 2025 Sep 8:S0306-4522(25)00926-1. https://doi.org/10.1016/j.neuroscience.2025.09.011
- Orzeł-Gajowik K, Milewski K, Obara-Michlewska M, Ellert-Miklaszewska A, Magiera A, Kwapiszewska K, Zielińska M. Unraveling Ammonia-Induced Brain Endothelial Senescence: Role of miRNA-183-5p. Antioxid Redox Signal. 2025 May 23. https://doi.org/10.1089/ars.2024.0784
-
Popek, M., Obara-Michlewska, M., Szewczyk, Ł.M. et al. Oedematic-atrophic astrocytes in hepatic encephalopathy. Acta Neuropathol Commun 13, 122 (2025). https://doi.org/10.1186/s40478-025-02045-5
- Biegański M, Szeliga M. Disrupted glutamate homeostasis as a target for glioma therapy. Pharmacol Rep. 2024 Dec;76(6):1305-1317. doi: 10.1007/s43440-024-00644-y. Epub 2024 Sep 11
- Zielińska M., Popek M., Albrecht J. Neuroglia in hepatic encephalopathy, pp. 191-212, in: Neuroglia in Neurologic and Psychiatric Disorders, part II, A. Verkhratsky, L.D. de Witte, E. Aronica, E.M. Hol, eds., Handbook of Clinical Neurology, vol. 210, 2025
- Albrecht J, Czuczwar SJ, Zielińska M, Miziak B. Methionine Sulfoximine as a Tool for Studying Temporal Lobe Epilepsy: Initiator, Developer, Attenuator. Neurochem Res. 2025 Jan 22;50(2):84. doi: 10.1007/s11064-024-04329-z
-
Kalinowski D., Bogus-Nowakowska K., The alteration of serotonergic markers in the amygdala and raphe nuclei of oestrogen receptor β knock-out female mice. Eur J Neurosci. 2024 Oct 30. doi: 10.1111/ejn.16580.
- Babiec L, Wilkaniec A, Gawinek E, Hilgier W, Adamczyk A. Inhibition of purinergic P2 receptors prevents synaptic and behavioral alterations in a rodent model of autism spectrum disorders. Elsevier. Research in Autism Spectrum Disorders112 (2024) 102353.
-
Orzeł- Gajowik K., Gajowik T., Rówienicz Ł., Zielińska M. The Ohm-azing custom-made Transendothelial Electrical Resistance measuring device (and why is it a current sensation?) Sensors and Actuators: B. Chemical 404 (2024) 135192.
- Buczkowska, J.; Szeliga, M. Two Faces of Glutaminase GLS2 in Carcinogenesis. Cancers 2023, 15, 5566. https://doi.org/10.3390/cancers15235566
-
Orzeł-Gajowik K., Milewski K., Zielińska M. miRNA-ome plasma analysis unveils changes in blood-brain barrier integrity associated with acute liver failure in rats. Fluids Barriers CNS. 2023 Dec 8;20(1):92. doi: 10.1186/s12987-023-00484-7
- Szeliga M, Rola R. Conoidin A, a Covalent Inhibitor of Peroxiredoxin 2, Reduces Growth of Glioblastoma Cells by Triggering ROS Production. Cells2023, 12(15), 1934; https://doi.org/10.3390/cells12151934
- Czarnecka AM, Obara-Michlewska M, Wesół-Kucharska D, Greczan M, Kaczor M, Książyk J, Rokicki D, Zielińska M. S100B Protein but Not 3-Nitrotyrosine Positively Correlates with Plasma Ammonia in Patients with Inherited Hyperammonemias: A New Promising Diagnostic Tool? J Clin Med. 2023 Mar 21;12(6):2411. doi: 10.3390/jcm12062411.
- Pawlik M., Czarnecka A.M., Kołodziej M., Skowrońska K., Węgrzynowicz M., Podgajna M., Czuczwar S.J., Albrecht J. Attenuation of initial pilocarpine-induced electrographic seizures by methionine sulfoximine pretreatment tightly correlates with the reduction of the extracellular taurine in the hippocampus. Epilepsia, 2023, https://doi.org/10.1111/epi.17554
- Szeliga M, Rola R. Menadione potentiates auranofin-induced glioblastoma cell death. International Journal of Molecular Sciences. 2022 Dec 11;23(24):15712. doi: 10.3390/ijms232415712 publikacja oryginalna. Open access.
- Obara-Michlewska M, Szeliga M. Editorial for the Neurochemistry International Special Issue "The oxidative/nitrosative stress in brain tumors". Neurochem Int. 2022 Sep;158:105377. doi: 10.1016/j.neuint.2022.105377.
- Sowińska M, Szeliga M, Morawiak M, Zabłocka B, Urbanczyk-Lipkowska Z Design, Synthesis and Activity of New N1-Alkyl Tryptophan Functionalized Dendrimeric Peptides against Glioblastoma. Biomolecules. 2022 Aug 13;12(8):1116. doi: 10.3390/biom12081116.
- Milewski K., Orzeł‑Gajowik K, Zielińska M. Mitochondrial Changes in Rat Brain Endothelial Cells Associated with Hepatic Encephalopathy: Relation to the Blood–Brain Barrier Dysfunction. Neurochemical Research Published: https://doi.org/10.1007/s11064-022-03698-7
-
Zielińska M., Albrecht J., Popek M. Dysregulation of Astrocytic Glutamine Transport in Acute Hyperammonemic Brain Edema. Front Neurosci. 2022; 16: 874750. Published online 2022 Jun 6. doi: 10.3389/fnins.2022.874750
- Obara-Michlewska M. The tryptophan metabolism, kynurenine pathway and oxidative stress - implications for glioma pathobiology. Neurochem Int. 2022 Jun 3;158:105363. doi: 10.1016/j.neuint.2022.105363. Online ahead of print.
-
Popek M, Bobula B, Orzeł-Gajowik K, Zielińska M. The Effect of TGF-β1 Reduced Functionality on the Expression of Selected Synaptic Proteins and Electrophysiological Parameters: Implications of Changes Observed in Acute Hepatic Encephalopathy. Int J Mol Sci. 2022 Jan 19;23(3):1081. doi: 10.3390/ijms23031081.
- Szeliga M. Comprehensive analysis of the expression levels and prognostic values of PRDX family genes in glioma. Neurochem Int. 2021 Dec 28; 153:105256. doi: 10.1016/j.neuint.2021.105256.
- Mielcarska MB, Skowrońska K, Wyżewski Z, Toka FN. Disrupting Neurons and Glial Cells Oneness in the Brain-The Possible Causal Role of Herpes Simplex Virus Type 1 (HSV-1) in Alzheimer's Disease. Int J Mol Sci. 2021 Dec 27;23(1):242. doi: 10.3390/ijms23010242.
- Orzeł-Gajowik K, Milewski K, Zielińska M. Insight into microRNAs-Mediated Communication between Liver and Brain: A Possible Approach for Understanding Acute Liver Failure? Int J Mol Sci. 2021 Dec 25;23(1):224. doi: 10.3390/ijms23010224.
- Pawlik, M.J.; Aldana, B.I.; Belfiori-Carrasco, L.F.; Obara-Michlewska, M.; Popek, M.P.; Czarnecka, A.M.; Albrecht, J. Inhibition of Glutamate Release, but Not of Glutamine Recycling to Glutamate, Is Involved in Delaying the Onset of Initial Lithium-Pilocarpine-Induced Seizures in Young Rats by a Non-Convulsive MSO Dose. Int. J. Mol. Sci. 2021, 22, 11127. https://doi.org/10.3390/ijms222011127
- Dąbrowska K., Skowrońska K. , Popek M., Albrecht J. and Zielińska M. The Role of Nrf2 Transcription Factor and Sp1-Nrf2 Protein Complex in Glutamine Transporter SN1 Regulation in Mouse Cortical Astrocytes Exposed to Ammonia. Int. J. Mol. Sci. 2021, 22(20), 11233; https://doi.org/10.3390/ijms222011233 (registering DOI)
- Pawlik M. J., Miziak B.,Walczak A., Konarzewska A., Chrościńska-Krawczyk M.,Albrecht J. and Czuczwar S. J. Selected Molecular Targets for Antiepileptogenesis. Int. J. Mol. Sci. 2021, 22, 9737 https://doi.org/10.3390/ijms22189737
- Hamdani E. H., Popek M., Frontczak-Baniewicz M., Utheim T.P. , Albrecht J. Zielińska M. Chaudhry F. A. Perturbation of astroglial Slc38 glutamine transporters by NH4+ contributes to neurophysiologic manifestations in acute liver failure. The Faseb Journal 2021 doi: 10.1096/fj.202001712RR
- Milewski K. , Czarnecka A. M. , Albrecht J. and Zielińska M. Decreased Expression and Uncoupling of Endothelial Nitric Oxide Synthase in the Cerebral Cortex of Rats with Thioacetamide-Induced Acute Liver Failure. Int. J. Mol. Sci. 2021, 22, 6662. https://doi.org/10.3390/ijms22136662
- Sowińska M, Szeliga M, Morawiak M, Ziemińska E, Zabłocka B, Urbańczyk-Lipkowska Z. Peptide dendrimers with non-symmetric bola structure exert long term effect on glioblastoma and neuroblastoma cell lines. Biomolecules 2021, 11(3), 435; https://doi.org/10.3390/biom11030435.
- Szeliga M, Albrecht J. Roles of nitric oxide and polyamines in brain tumor growth. Adv Med Sci. 2021 Mar 9;66(1):199-205. doi: 10.1016/j.advms.2021.02.006
- Pawlik MJ, Obara-Michlewska M, Popek MP, Czarnecka AM, Czuczwar SJ, Łuszczki J, Kołodziej M, Acewicz A, Wierzba-Bobrowicz T, Albrecht J. Pretreatment with a glutamine synthetase inhibitor MSO delays the onset of initial seizures induced by pilocarpine in juvenile rats. Brain Res. 2021 Jan 7;147253. DOI: 10.1016/j.brainres.2020.147253
- Szeliga M. Peroxiredoxins in Neurodegenerative Diseases. Antioxidants (Basel). 2020 Nov 30;9(12):E1203. doi: 10.3390/antiox9121203 Praca przeglądowa. Forma dostępu: open acces.
- Czarnecka AM ,Milewski K, Albrecht J, Zielińska M. The Status of Bile Acids and Farnesoid X Receptor in Brain and Liver of Rats with Thioacetamide-Induced Acute Liver Failure. Int. J. Mol. Sci. 2020, 21(20), 7750; https://doi.org/10.3390/ijms21207750
- Szeliga M, Karpińska M, Rola R, Niewiadomy A. Design, synthesis and biological evaluation of novel 1,3,4-thiadiazole derivatives as anti-glioblastoma agents targeting the AKT pathway. Bioorg Chem. 2020 Oct 9;105:104362. doi: 10.1016/j.bioorg.2020.104362.
- Skowrońska K, Kozłowska H, Albrecht J. Neuron-derived factors negatively modulate ryanodine receptor-mediated calcium release in cultured mouse astrocytes. Cell Calcium. 2020. 92: 102304. doi: 10.1016/j.ceca.2020.102304
- Szeliga M. Thiadiazole derivatives as anticancer agents. Pharmacol Rep. 2020 Sep 3. doi:10.1007/s43440-020-00154-7
- Popek M, Bobula B, Sowa J, Hess G, Frontczak-Baniewicz M, Albrecht J, Zielińska M. Physiology and morphological correlates of excitatory transmission are preserved in glutamine transporter SN1- depleted mouse frontal cortex. Neuroscience 2020 August 26 https://doi.org/10.1016/j.neuroscience.2020.08.019
- Czarnecka AM, Hilgier W, Zielińska M. S-Adenosylmethionine Deficiency and Brain Accumulation of S-Adenosylhomocysteine in Thioacetamide-Induced Acute Liver Failure. Nutrients 2020, 12(7), 2135; https://doi.org/10.3390/nu12072135
- Czarnecka A, Zielińska M. Po co nam kwasy żółciowe w mózgu? KOSMOS 69, 1, 37–44, 2020 https://kosmos.ptpk.org/index.php/Kosmos/issue/view/150
- Obara-Michlewska M, Szeliga M. Targeting Glutamine Addiction in Gliomas. Cancers (Basel). 2020 Jan 29;12(2). Pii: E310. doi: 10.3390/cancers12020310.
- Milewski K, Bogacińska-Karaś M, Hilgier W, Albrecht J, Zielińska M. TNFα increases STAT3-mediated expression of glutaminase isoform KGA in cultured rat astrocytes. Cytokine. 2019 Jul 22;123:154774. doi: 10.1016/j.cyto.2019.154774.
- Albrecht J, Zielińska M. Exchange-mode glutamine transport across CNS cell membranes. Neuropharmacology 2019 Mar 8. Pii: S0028-3908(19)30081-4. Doi: 10.1016/j.neuropharm.2019.03.003.
- Majewska E, Márquez J, Albrecht J, Szeliga M. Transfection with GLS2 Glutaminase (GAB) Sensitizes Human Glioblastoma Cell Lines to Oxidative Stress by a Common Mechanism Involving Suppression of the PI3K/AKT Pathway. Cancers (Basel). 2019 Jan 19;11(1). Pii: E115. doi: 10.3390/cancers11010115.
- Skowrońska K, Obara-Michlewska M, Zielińska M, Albrecht J. NMDA Receptors in Astrocytes: In Search for Roles in Neurotransmission and Astrocytic Homeostasis. Int J Mol Sci. 2019 Jan 14;20(2). Pii: E309. doi: 10.3390/ijms20020309.
- Dąbrowska K, Zielińska M Silencing of Transcription Factor Sp1 Promotes SN1 Transporter Regulation by Ammonia in Mouse Cortical Astrocytes. Int J Mol Sci. 2019 Jan 9;20(2). Pii: E234. doi: 10.3390/ijms20020234.
- Skowrońska K, Obara-Michlewska M, Czarnecka A, Dąbrowska K, Zielińska M, Albrecht J. Persistent Overexposure to N-Methyl-D-Aspartate (NMDA) Calcium-Dependently Downregulates Glutamine Synthetase, Aquaporin 4, and Kir4.1 Channel in Mouse Cortical Astrocytes. Neurotox Res. 2019 Jan;35(1):271-280. doi: 10.1007/s12640-018-9958-3. Epub 2018 Sep 15.
- Czarnecka A, Aleksandrowicz M, Jasiński K, Jaźwiec R, Kalita K, Hilgier W, Zielińska M. Cerebrovascular reactivity and cerebral perfusion of rats with acute liver failure: role of L-glutamine and asymmetric dimethylarginine in L-arginine-induced response. J Neurochem. 2018 Dec;147(5):692-704. doi: 10.1111/jnc.14578. Epub 2018 Nov 6.
- Dąbrowska K, Albrecht J, Zielińska M. Protein kinase C-mediated impairment of glutamine outward transport and SN1 transporter distribution by ammonia in mouse cortical astrocytes. Neurochem Int. 2018 Sep;118:225-232. doi: 10.1016/j.neuint.2018.07.001. Epub 2018 Jul 3.
- Dabrowska K, Skowronska K, Popek M, Obara-Michlewska M, Albrecht J, Zielinska M. Roles of Glutamate and Glutamine Transport in Ammonia Neurotoxicity: State of the Art and Question Marks. Endocr Metab Immune Disord Drug Targets. 2018;18(4):306-315. doi: 10.2174/1871520618666171219124427.
- Obara-Michlewska M, Ding F, Popek M, Verkhratsky A, Nedergaard M, Zielinska M, Albrecht J. Interstitial ion homeostasis and acid-base balance are maintained in oedematous brain of mice with acute toxic liver failure. Neurochem Int. 2018 Sep;118:286-291. doi: 10.1016/j.neuint.2018.05.007. Epub 2018 May 14.
- Popek M, Bobula B, Sowa J, Hess G, Polowy R, Filipkowski RK, Frontczak-Baniewicz M, Zabłocka B, Albrecht J, Zielińska M. Cortical Synaptic Transmission and Plasticity in Acute Liver Failure Are Decreased by Presynaptic Events. Mol Neurobiol. 2018 Feb;55(2):1244-1258. doi: 10.1007/s12035-016-0367-4. Epub 2017 Jan 23.
- Milewski K, Bogacińska-Karaś M, Fręśko I, Hilgier W, Jaźwiec R, Albrecht J, Zielińska M. Ammonia Reduces Intracellular Asymmetric Dimethylarginine in Cultured Astrocytes Stimulating Its y⁺LAT2 Carrier-Mediated Loss. Int J Mol Sci. 2017 Nov 2;18(11). Pii: E2308. doi: 10.3390/ijms18112308.
- Majewska E, Rola R, Barczewska M, Marquez J, Albrecht J, Szeliga M. Transcription factor GATA3 expression is induced by GLS2 overexpression in a glioblastoma cell line but is GLS2-independent in patient-derived glioblastoma. J Physiol Pharmacol. 2017 Apr;68(2):209-214.
- Zielińska M, Aschner M. Enthusiasm Scientifically Oriented: The Preface for the Special Issue Dedicated to Jan Albrecht. Neurochem Res. 2017 Mar;42(3):711-712. doi: 10.1007/s11064-016-2164-x.
- Czarnecka A, Milewski K, Zielińska M. Asymmetric Dimethylarginine and Hepatic Encephalopathy: Cause, Effect or Association? Neurochem Res. 2017 Mar;42(3):750-761. doi: 10.1007/s11064-016-2111-x. Epub 2016 Nov 25.
- Majewska E, Szeliga M. AKT/GSK3β Signaling in Glioblastoma. Neurochem Res. 2017 Mar;42(3):918-924. doi: 10.1007/s11064-016-2044-4. Epub 2016 Aug 27.
- Czarnecka A, Milewski K, Jaźwiec R, Zielińska M. Intracerebral Administration of S-Adenosylhomocysteine or S-Adenosylmethionine Attenuates the Increases in the Cortical Extracellular Levels of Dimethylarginines Without Affecting cGMP Level in Rats with Acute Liver Failure. Neurotox Res. 2017 Jan;31(1):99-108. doi: 10.1007/s12640-016-9668-7. Epub 2016 Sep 8.
- Zielińska M, Dąbrowska K, Hadera MG, Sonnewald U, Albrecht J. System N transporters are critical for glutamine release and modulate metabolic fluxes of glucose and acetate in cultured cortical astrocytes: changes induced by ammonia. J Neurochem. 2016 Jan;136(2):329-38. Doi: 10.1111/jnc.13376. Epub 2015 Nov 10.
- Milewski K, Hilgier W, Fręśko I, Polowy R, Podsiadłowska A, Zołocińska E, Grymanowska AW, Filipkowski RK, Albrecht J, Zielińska M. Carnosine Reduces Oxidative Stress and Reverses Attenuation of Righting and Postural Reflexes in Rats with Thioacetamide-Induced Liver Failure. Neurochem Res. 2016 Feb;41(1-2):376-84. doi: 10.1007/s11064-015-1821-9. Epub 2016 Jan 22.
- Szeliga M, Ćwikła J, Obara-Michlewska M, Cichocki A, Albrecht J. Glutaminases in slowly proliferating gastroenteropancreatic neuroendocrine neoplasms/tumors (GEP-NETs): Selective overexpression of mRNA coding for the KGA isoform. Exp Mol Pathol. 2016 Feb;100(1):74-8. doi: 10.1016/j.yexmp.2015.11.017. Epub 2015 Nov 12.
- Szeliga M, Różycka A, Jędrak P, Barańska S, Janik P, Jamrozik Z, Albrecht J. Expression of RNAs Coding for Metal Transporters in Blood of Patients with Huntington’s Disease. Neurochem Res. 2016 Feb;41(1-2):101-6. doi: 10.1007/s11064-015-1737-4. Epub 2015 Oct 15.
- Szeliga M, Bogacińska-Karaś M, Kuźmicz K, Rola R, Albrecht J. Downregulation of GLS2 in glioblastoma cells is related to DNA hypermethylation but not to the p53 status. Mol 2016 Sep;55(9):1309-16. Doi: 10.1002/mc.22372. Epub 2015 Aug 10.
- Albrecht J, Zielińska M. Mechanisms of Excessive Extracellular Glutamate Accumulation in Temporal Lobe Epilepsy. Neurochem Res. 2017 Jun;42(6):1724-1734. doi: 10.1007/s11064-016-2105-8. Epub 2016 Nov 21.
- Milewski K, Oria M. What we know: the inflammatory basis of hepatic encephalopathy. Metab Brain Dis. 2016 Dec;31(6):1239-1247. Epub 2015 Oct 26.
- Jęśko H, Wilkaniec A, Cieślik M, Hilgier W, Gąssowska M, Lukiw WJ, Adamczyk A1.Altered Arginine Metabolism in Cells Transfected with Human Wild-Type Beta Amyloid Precursor Protein (βAPP). Curr Alzheimer Res. (2016) 13(9):1030-9.
- Zielińska M, Milewski K, Skowrońska M, Gajos A, Ziemińska E, Beręsewicz A, Albrecht J. Induction of inducible nitric oxide synthase expression in ammonia-exposed cultured astrocytes is coupled to increased arginine transport by upregulated y(+)LAT2 transporter. J Neurochem. 2015 Dec;135(6):1272-81. doi: 10.1111/jnc.13387. Epub 2015 Nov 6.
- Zieminska, A. Stafiej, B. Toczylowska B, J. Albrecht, MED. Łazarewicz. Role of Ryanodine and NMDA Receptors in Tetrabromobisphenol A-Induced Calcium Imbalance and Cytotoxicity in Primary Cultures of Rat Cerebellar Granule Cells. Neurotox Res. 2015 Oct;28(3):195-208. doi: 10.1007/s12640-015-9546-8.
- Milewski K, Hilgier W, Albrecht J, Zielińska M.The dimethylarginine (ADMA)/nitric oxide pathway in the brain and periphery of rats with thioacetamide-induced acute liver failure: Modulation by histidine. Neurochem Int. 2015 Sep;88:26-31. doi: 10.1016/j.neuint.2014.12.004. Epub 2014 Dec 15.
- Ruszkiewicz J, Albrecht J.Changes of the thioredoxin system, glutathione peroxidase activity and total antioxidant capacity in rat brain cortex during acute liver failure: modulation by L-histidine. Neurochem Res. 2015 Feb;40(2):293-300. doi: 10.1007/s11064-014-1417-9. Epub 2014 Aug 27.
- Szeliga M, Albrecht J Opposing roles of glutaminase isoforms in determining glioblastoma cell phenotype. Neurochem Int. 2015 Sep;88:6-9. doi: 10.1016/j.neuint.2014.11.004. Epub 2014 Dec 18.
- Ruszkiewicz J, Albrecht J Changes in the mitochondrial antioxidant systems in neurodegenerative diseases and acute brain disorders. Neurochem Int. 2015 Sep;88:66-72. doi: 10.1016/j.neuint.2014.12.012. Epub 2015 Jan 6.
- Obara-Michlewska M, Ruszkiewicz J, Zielińska M, Verkhratsky A, Albrecht J Astroglial NMDA receptors inhibit expression of Kir4.1 channels in glutamate-overexposed astrocytes in vitro and in the brain of rats with acute liver failure. Neurochem Int. 2015 Sep;88:20-5. doi: 10.1016/j.neuint.2014.10.006. Epub 2014 Oct 23.
- Albrecht J, Zielińska M. Deficit of astroglia-derived thrombospondin-1 and loss of synaptic proteins in hepatic encephalopathy: do ammonia-overexposed astrocytes derange the synaptic hardware? J Neurochem. 2014 Nov;131(3):265-7. doi: 10.1111/jnc.12823. Epub 2014 Aug 8.
- Zielińska M, Obara-Michlewska M, Hilgier W, Albrecht J.Citrulline uptake in rat cerebral cortex slices: modulation by Thioacetamide -Induced hepatic failure. Metab Brain Dis. 2014 Dec;29(4):1053-60. doi: 10.1007/s11011-013-9472-5. Epub 2014 Jan 3.
- Albrecht (2014) Ammonia. In: Aminoff M.J. and Daroff R.B. (eds.) Encyclopedia of the Neurological Sciences, 2nd edition, vol. 1, pp. 148-151. Oxford: Academic Press.
- Hilgier W, Kocki T, Obara-Michlewska M, Turski WA, Oja SS, Saransaari P, Albrecht J. Modulation by kynurenine of extracellular kynurenate and glutamate in cerebral cortex of rats with acute liver failure. Pharmacol Rep.2014 Jun;66(3):466-70. doi: 10.1016/j.pharep.2013.11.007. Epub 2014 Apr 13.
- Zielińska M, Popek M, Albrecht J. Roles of changes in active glutamine transport in brain edema development during hepatic encephalopathy: an emerging concept. Neurochem Res. 2014;39(3):599-604. doi: 10.1007/s11064-013-1141-x. Epub 2013 Sep 26.
- Martín-Rufián M, Nascimento-Gomes R, Higuero A, Crisma AR, Campos-Sandoval JA, Gómez-García MC, Cardona C, Cheng T, Lobo C, Segura JA, Alonso FJ, Szeliga M, Albrecht J, Curi R, Márquez J, Colquhoun A, Deberardinis RJ, Matés JM. Both GLS silencing and GLS2 overexpression synergize with oxidative stress against proliferation of glioma cells. J Mol Med. (Berl) 2014 Mar;92(3):277-90. doi: 10.1007/s00109-013-1105-2. Epub 2013 Nov 26.
- Szeliga M, Bogacińska-Karaś M, Różycka A, Hilgier W, Marquez J, Albrecht J. Silencing of GLS and overexpression of GLS2 genes cooperate in decreasing the proliferation and viability of glioblastoma cells. Tumour Biol. 2014 Mar;35(3):1855-62. doi: 10.1007/s13277-013-1247-4. Epub 2013 Oct 6.
- Obara-Michlewska M, Tuszyńska P, Albrecht J. Ammonia upregulates kynurenine aminotransferase II mRNA expression in rat brain: a role for astrocytic NMDA receptors? Metab Brain Dis. 2013 Jun;28(2):161-5. doi: 10.1007/s11011-012-9353-3. Epub 2012 Nov 8.
- Ruszkiewicz J, Fręśko I, Hilgier W, Albrecht J. Decrease of glutathione content in the prefrontal cortical mitochondria of rats with acute hepatic encephalopathy: prevention by histidine. Metab Brain Dis. 2013 Mar;28(1):11-4. doi: 10.1007/s11011-012-9342-6. Epub 2012 Oct 20.
- Skowrońska M, Albrecht J. Oxidative and nitrosative stress in ammonia neurotoxicity. Neurochem Int. 2013 Apr;62(5):731-7. doi: 10.1016/j.neuint.2012.10.013. Epub 2012 Nov 7.
- Szeliga M, Zgrzywa A, Obara-Michlewska M, Albrecht J.Transfection of a human glioblastoma cell line with liver-type glutaminase (LGA) down-regulates the expression of DNA-repair gene MGMT and sensitizes the cells to alkylating agents. J Neurochem. 2012 Nov;123(3):428-36. doi: 10.1111/j.1471-4159.2012.07917.x. Epub 2012 Sep 21.
- Juszczak M, Matysiak J, Szeliga M,Pożarowski P, Niewiadomy A, Albrecht J, Rzeski W. 2-Amino-1,3,4-thiadiazole derivative (FABT) inhibits the extracellular signal-regulated kinase pathway and induces cell cycle arrest in human non-small lung carcinoma cells. Bioorg Med Chem Lett. 2012 Sep 1;22(17):5466-9. doi: 10.1016/j.bmcl.2012.07.036. Epub 2012 Jul 20.
- Skowrońska M, Zielińska M,Wójcik-Stanaszek L, Ruszkiewicz J, Milatovic D, Aschner M, Albrecht J. Ammonia increases paracellular permeability of rat brain endothelial cells by a mechanism encompassing oxidative/nitrosative stress and activation of matrix metalloproteinases. J Neurochem. 2012 Apr;121(1):125-34. doi: 10.1111/j.1471-4159.2012.07669.x. Epub 2012 Feb 15.
- Zielińska M, Skowrońska M, Fręśko I, Albrecht J. Upregulation of the heteromeric y(+)LAT2 transporter contributes to ammonia-induced increase of arginine uptake in rat cerebral cortical astrocytes. Neurochem Int. 2012 Sep;61(4):531-5. doi: 10.1016/j.neuint.2012.02.021. Epub 2012 Feb 27.
- Skowrońska M, Albrecht J. Alterations of blood brain barrier function in hyperammonemia: an overview. Neurotox Res. 2012 Feb;21(2):236-44. doi: 10.1007/s12640-011-9269-4. Epub 2011 Aug 27.
- Hilgier W, Łazarewicz JW, Strużynska L, Frontczak-Baniewicz M, Albrecht J. Repeated exposure of adult rats to Aroclor 1254 induces neuronal injury and impairs the neurochemical manifestations of the NMDA receptor-mediated intracellular signaling in the hippocampus. 2012 Jan;33(1):16-22. doi: 10.1016/j.neuro.2011.10.005. Epub 2011 Oct 21.







