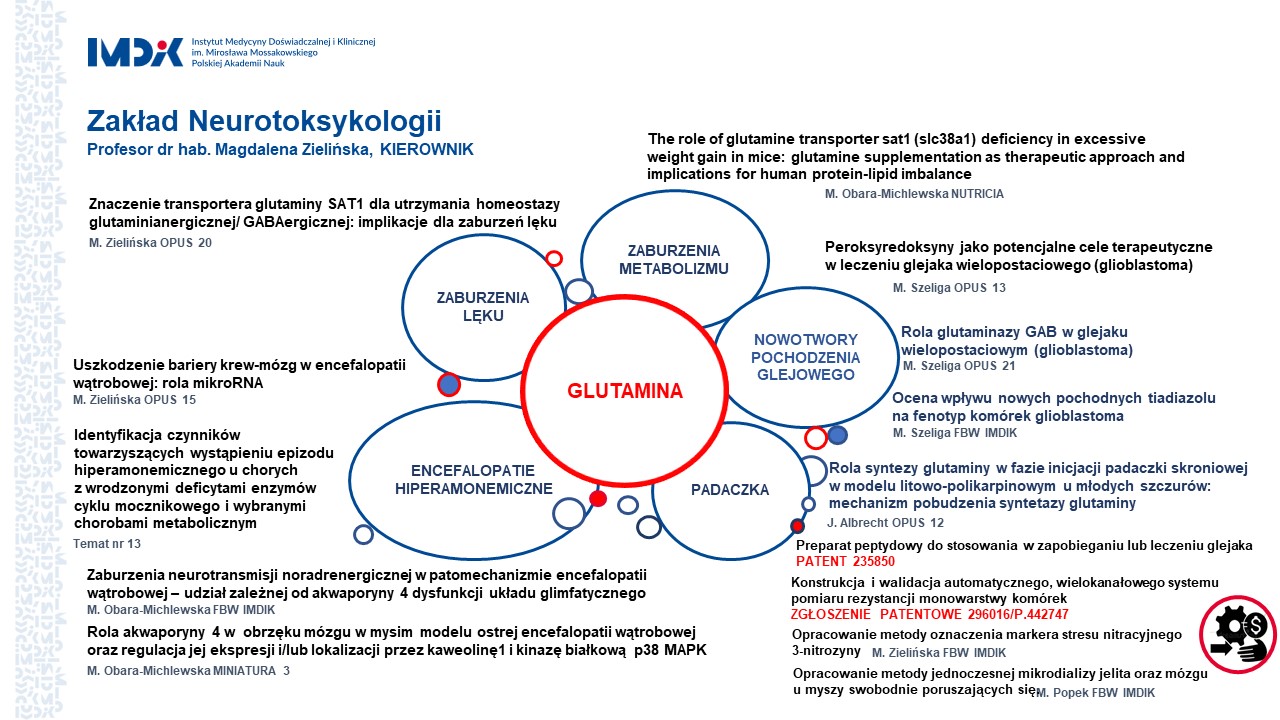
Zakład Neurotoksykologii
Kierownik
Prof. dr hab. n. med. Magdalena Zielińska, tel. 22 60 86 470, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript. ; pokój C-202
Sekretariat
Dorota Rycko, tel. 22 60 86 417, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript. ; pokój C-222; C-209
Pracownicy naukowi
prof. dr hab. Jan Albrecht, tel. 22 60 86 617, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr hab. Monika Szeliga, prof. IMDiK, tel. 22 60 86 416, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Marta Obara – Michlewska, tel. 22 60 86 416, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Mariusz Popek, tel. 22 60 86 442, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Daniel Kalinowski, tel. 22 60 86 416, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Karolina Orzeł-Gajowik, tel. 22 60 86 442, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Marius Bidon, tel. 22 60 86 416, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Pracownicy naukowo-techniczni
mgr Małgorzata Bogacińska-Karaś, tel. 22 60 86 440; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr Kamila Szumska, tel. 22 60 86 417; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Doktoranci
mgr Zuzanna Sulej tel. 22 60 86 442; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr Subati Saimati tel. 22 60 86 442; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Absolwenci i byli pracownicy
dr Anna Czarnecka
dr Marek Pawlik
dr Krzysztof Milewski
dr Katarzyna Skowrońska
dr inż. Ewelina Majewska
dr inż. Katarzyna Dąbrowska
mgr Aleksandra Nakonieczna UW
inż. Katarzyna Serafin PW
inż. Karolina Strzelczyk PW
inż. Julia Urbanek PW
inż. Aleksandra Mróz PW
licencjat Wiktoria Pietrowicz SGGW
Profil badawczy
- Mechanizmy komórkowe i molekularne leżące u podłoża encefalopatii wątrobowej (EW).
- Współdziałanie astrocytów, neuronów i komórek śródbłonka naczyń mózgowych w powstawaniu obrzęku mózgu towarzyszącego EW.
- Rola stresu oksydacyjnego i nitracyjnego (SON): udział glutaminy i amoniaku w indukcji SON.
- Rola sygnalizacji komórkowej związanej z cyklicznym GMP i kanałów jonowych.
- Glutamina a fenotyp glejaków złośliwych: udział glutaminaz.
- Rola glutaminy w patomechanizmie padaczki skroniowej.
Granty
- Nowa perspektywa udziału mitochondriów w rozwoju cytotoksycznego obrzęku mózgu w ostrej niewydolności wątroby - grant SONATA 19 nr 2023/51/D/NZ5/02035 Narodowego Centrum Nauki, kierownik projektu: dr Mariusz Popek (2024-2027)
- Znaczenie sygnalizacji estrogenowego receptora β w neuronach korowych w warunkach stresu — rola miRNA - grant MINIATURA 8 nr 2024/08/X/NZ5/00349 Narodowego Centrum Nauki, kierownik projektu: dr Daniel Kalinowski (2024-2025)
- Zależność alprazolamu w ujęciu sygnalizacji estrogenowej w modelu myszy z przewlekłym stresem. Projekt finansowany z Funduszu Badań Własnych, kierownik projektu: dr Daniel Kalinowski (2024-2025)
- Zaburzenia neurotransmisji noradrenergicznej w patomechanizmie encefalopatii wątrobowej – udział zależnej od akwaporyny 4 dysfunkcji układu glimfatycznego. Projekt finansowany z Funduszu Badań Własnych, kierownik projektu: dr Marta Obara-Michlewska (2023-2024)
- Konstrukcja i walidacja automatycznego, wielokanałowego systemu pomiaru rezystancji monowarstwy komórek. Projekt finansowany z Funduszu Badań Własnych, kierownik projektu: mgr Karolina Orzeł-Gajowik (2022-2023)
- Rola glutaminazy GAB w glejaku wielopostaciowym (glioblastoma); grant OPUS 21 nr 2021/41B/NZ5/01883 Narodowego Centrum Nauki, kierownik projektu: dr hab. Monika Szeliga (2021-2025)
- Znaczenie transportera glutaminy SAT1 dla utrzymania homeostazy glutaminianergicznej/ GABAergicznej: implikacje dla zaburzeń lęku. grant OPUS 20 nr 2020/39/B/NZ5/01962 Narodowego Centrum Nauki, kierownik projektu: prof. dr hab. Magdalena Zielińska , (2021 - 2024)
- The role of glutamine transporter sat1 (slc38a1) deficiency in excessive weight gain in mice –glutamine supplementation as therapeutic approach and implications for human protein-lipid imbalance; Projekt Fundacji NUTRICIA nr RG 3/2020, kierownik projektu: dr Marta Obara-Michlewska (2020-2022)
- Ocena wpływu nowych pochodnych tiadiazolu na fenotyp komórek glioblastoma. Projekt finansowany z Funduszu Badań Własnych, kierownik projektu: dr hab. Monika Szeliga (2021-2022)
- Opracowanie metody oznaczenia markera stresu nitracyjnego -3-nitrozyny. Projekt finansowany z Funduszu Badań Własnych; kierownik projektu: prof. dr hab. Magdalena Zielińska (2021-2022)
- Opracowanie metody jednoczesnej mikrodializy jelita oraz mózgu u myszy swobodnie poruszających się. Projekt finansowany z Funduszu Badań Własnych, kierownik projektu: dr Mariusz Popek (2021-2022)
- Rola akwaporyny 4 w obrzęku mózgu w mysim modelu ostrej encefalopatii wątrobowej oraz regulacja jej taffsji i/lub lokalizacji przez kaweolinę1 i kinazę białkową p38 MAPK; grant MINIATURA 3 nr 2019/03/X/NZ4/00623 Narodowego Centrum Nauki, kierownik: dr Marta Obara-Michlewska (2019-2020)
- Rola astrocytarnych receptorów NMDA w regulacji aktywności syntetazy glutaminy w hodowanych astrocytach mysich. Próba zdefiniowania wewnątrzastrocytarnych szlaków sygnałowych; grant PRELUDIUM 14 nr 2017/27/N/NZ3/02819 Narodowego Centrum Nauki, kierownik: mgr Katarzyna Skowrońska (2018-2020)
- Peroksyredoksyny jako potencjalne cele terapeutyczne w leczeniu glejaka wielopostaciowego (glioblastoma), grant OPUS 13 nr 2017/25/B/NZ7/00388 Narodowego Centrum Nauki, kierownik: dr Monika Szeliga (2018-2023)
- Rola syntezy glutaminy w fazie inicjacji padaczki skroniowej w modelu litowo-polikarpinowym u młodych szczurów: mechanizm pobudzenia syntetazy glutaminy ; grant OPUS 12 nr 2016/23/B/NZ4/03678 Narodowego Centrum Nauki, kierownik: prof. dr hab. Jan Albrecht (2017-2022)
- Uszkodzenie bariery krew-mózg w encefalopatii wątrobowej: rola mikroRNA; grant OPUS 10 nr 2015/19/B/NZ4/01902 Narodowego Centrum Nauki, kierownik: dr hab. Magdalena Zielińska (2016-2022)
- Udział czynnika transkrypcyjnego SP1 w regulacji ekspresji astrocytarnego transportera glutaminy SN1 : wpływ jonów amonowych i interakcji astrocyt-neuron; grant PRELUDIUM 11, nr 2016/21/N/NZ4/03759 Narodowego Centrum Nauki kierownik: mgr inż. Katarzyna Dąbrowska (2017-2020)
- Szlak sygnałowy związany z kinazą białkową B w komórkach glioblastoma transfekowanych glutaminazą typu wątrobowego (gab), grant PRELUDIUM 12 nr 2016/23/N/NZ5/01428 Narodowego Centrum Nauki, kierownik: mgr inż. Ewelina Majewska (2017-2019)
- Receptor farnezylowy X w mózgu – nowy element w patomechanizmie ostrej encefalopatii wątrobowej , grant MINIATURA1 nr 2017/01/X/NZ4/00110 Narodowego Centrum Nauki, kierownik: dr Anna Czarnecka (2017-2018)
- Zmiany w składzie białkowym i własnościach elektrofizjologicznych synapsy glutamatergicznej w mysim modelu ostrej encefalopatii wątrobowej: rola tkankowego czynnika wzrostu β1 (TGF β1) , grant PRELUDIUM 10 nr 2015/19/N/NZ5/02249 Narodowego Centrum Nauki, kierownik: mgr inż. Mariusz Popek (2016-2019)
- Regulacja ekspresji astrocytarnej glutaminazy przez czynniki zapalne w encefalopatii wątrobowej, grant PRELUDIUM nr 2014/15/N/NZ5/03634 Narodowego Centrum Nauki, kierownik: projektu mgr Krzysztof Milewski (2015 – 2017)
- Rola mózgowej asymetrycznej dwumetyloargininy (ADMA)w encefalopatii wątrobowej: marker, mediator czy regulator? Grant OPUS nr 2013/09/B/NZ4/00536 Narodowego Centrum Nauki, kierownik: dr hab. Magdalena Zielińska (2014-2017)
- Nowe pochodne 1,3,4-thiadiazoli jako inhibitory kluczowych etapów cyklu glutamina-glutaminian w komórkach glioblastoma, grant SONATA nr 2013/11/D/NZ7/00925, Narodowego Centrum Nauki, kierownik: dr Monika Szeliga (2014-2017)
- Udział transportu glutaminazy w pojawianiu się obrzęku mózgu i zaburzeń funkcji synapsy glutaminianergicznej związanych z encefalopatią wątrobową, grant nr Pol-Nor/196190/26/2013, Narodowego Centrum Badań i Rozwoju w ramach Programu Polsko-Norweskiej Współpracy Badawczej “CORE”, kierownik: prof. dr hab. Jan Albrecht (2013-2016)
- Rola astrocytarnych receptorów NMDA w hiperamonemicznym obrzęku mózgu towarzyszącym encefalopatii wątrobowej, grant HARMONIA nr 2013/08/M/NZ3/00869 Narodowego Centrum Nauki, kierownik: prof. dr hab. Jan Albrecht (2013-2016)
Współpraca krajowa
- Instytut Pomnik-Centrum Zdrowia Dziecka w Warszawie (dr Dariusz Rokicki)
- Uniwersytet Medyczny w Lublinie (prof. Waldemar A. Turski)
- Uniwersytet Medyczny w Lublinie (prof. Stanisław Czuczwar)
- Instytut Farmakologii im. Jerzego Maja Polskiej Akademii Nauk w Krakowie (prof. Grzegorz Hess)
- Uniwersytet Medyczny w Lublinie; Katedra i Klinika Neurochirurgii i Neurochirurgii Dziecięcej (prof. Radosław Rola)
- Uniwersytet Warmińsko-Mazurski; Wydział Lekarski, Katedra Kardiologii i Chorób Wewnętrznych (dr hab. n. med. Jarosław Ćwikła)
Współpraca zagraniczna
- Faculty of Life Science, University of Manchester, UK (prof. Alexei Verkhratsky)
- The Biotechnology Centre of Oslo, University of Oslo, Norway (prof. Farrukh A. Chaudhry)
- Faculty of Sciences, University of Málaga, Spain (prof. Javier Marquez)
- Department of Drug Design and Pharmacology, Faculty of Health and Medical Sciences, University of Copenhagen, Denmark (Prof. Helle S. Waagepetersen, Dr. Blanca I. Aldana)
Aparatura
- urządzenie IDEXX Catalyst One do analizy biochemicznej wybranych parametrów pełnej krwi, osocza lub surowicy
- zestaw do HPLC firmy Dionex z detektorem fluorescencyjnym, elektrochemicznym, autosamplerem i termostatem kolumn
- termocykler Biometra, 3 bloki (48 miejsc w każdym bloku)
- czytnik ELISA (Micrplate Reader – płytki 96-dołkowe) Bio-Rad; filtry: 415, 450, 480, 570, 595, 655, 750 nm i płytką do oznaczania kwasów nukleinowych
- aparat do dokumentacji i analizy materiałów znakowanych chemiluminescencyjnie (med. Western-blot), fluorescencyjnie (med. bromek etydyny) i kolorymetrycznie, G-Box firmy Syngene
- aparat stereotaktyczny firmy Stoelting CO
- zestaw do mikrodializy wolnobiegających małych zwierząt laboratoryjnych
- system do perfuzji ciągłej skrawków model 745
- aparat Brandel przystosowany do badań izolowanych preparatów (skrawki) i na hodowlach komórkowych
- aparat do transfekcji komórek Lonza
- mikroskop fluorescencyjny JuLI
- zestaw Pinnacle 8400 do rejestracji EEG, EMG oraz obrazu u wolno-biegających myszy lub szczurów
Metody badawcze
Biochemiczne/ molekularne:
- metody radioizotopowe: analiza transportu znakowanych aminokwasów; wiązania radioligandów receptorów
- pomiar generacji wtórnych przekaźników (cykliczny AMP, cykliczny GMP), oznaczanie ilościowe aminokwasów, ich pochodnych, innych związków z wykorzystaniem chromatografii; ocena aktywności enzymatycznej metodami kolorymetrycznymi, immonoenzymatycznymi (ELISA), cytometria przepływowa
- hodowle pierwotne komórek układu nerwowego; hodowle komórek ludzkich; hodowle linii komórkowych ze stabilną ekspresją genów kodujących wybrane białka; klonowanie; transfekcja
- techniki immunocytochemii, immunohistochemii do wizualizacji morfologicznej oraz jakościowej analizy wybranych białek; fluorescencyjna analiza mikroskopowa
- genotypowanie zwierząt techniką klasycznego PCR; ilościowe oznaczenia ekspresji mRNA (Real Time PCR); białka (Western Blot); frakcjonowanie białek błonowych i wewnątrzkomórkowych
Behawioralne:
- testy: poziom lęku (uniesiony labirynt krzyżowy), zachowania depresyjne (FST); sensomotoryczne (spontaniczna ruchliwość (OF, RotaRod, Griptest); basen Morrisa
- modele: ostrej encefalopatii wątrobowej; podwiązania dróg żółciowych (BDL); hiperamonemii prostej; litowo-pilokarpinowy model padaczki skroniowej u szczura; stresu unieruchomienia
- instrumentalne: implantacja stereotaktyczna kaniuli do określonych miejsc kory mózgowej (PFC) i podawania związków; izolacja struktur mózgowych; perfuzja-dializa mózgowa małych zwierząt laboratoryjnych (wolno-biegających oraz w narkozie).
Patenty
tytuł: Preparat peptydowy do stosowania w zapobieganiu lub leczeniu glejaka. numer patentu: 235850; data ogłoszenia: 2020-04-08
autorzy: Szeliga Monika, Lipkowski Andrzej, Różycki Krzysztof
Wybrane publikacje
- Zielińska M., Popek M., Albrecht J. Neuroglia in hepatic encephalopathy, pp. 191-212, in: Neuroglia in Neurologic and Psychiatric Disorders, part II, A. Verkhratsky, L.D. de Witte, E. Aronica, E.M. Hol, eds., Handbook of Clinical Neurology, vol. 210, 2025
- Albrecht J, Czuczwar SJ, Zielińska M, Miziak B. Methionine Sulfoximine as a Tool for Studying Temporal Lobe Epilepsy: Initiator, Developer, Attenuator. Neurochem Res. 2025 Jan 22;50(2):84. doi: 10.1007/s11064-024-04329-z
-
Kalinowski D., Bogus-Nowakowska K., The alteration of serotonergic markers in the amygdala and raphe nuclei of oestrogen receptor β knock-out female mice. Eur J Neurosci. 2024 Oct 30. doi: 10.1111/ejn.16580.
- Babiec L, Wilkaniec A, Gawinek E, Hilgier W, Adamczyk A. Inhibition of purinergic P2 receptors prevents synaptic and behavioral alterations in a rodent model of autism spectrum disorders. Elsevier. Research in Autism Spectrum Disorders112 (2024) 102353.
-
Orzeł- Gajowik K., Gajowik T., Rówienicz Ł., Zielińska M. The Ohm-azing custom-made Transendothelial Electrical Resistance measuring device (and why is it a current sensation?) Sensors and Actuators: B. Chemical 404 (2024) 135192.
- Buczkowska, J.; Szeliga, M. Two Faces of Glutaminase GLS2 in Carcinogenesis. Cancers 2023, 15, 5566. https://doi.org/10.3390/cancers15235566
-
Orzeł-Gajowik K., Milewski K., Zielińska M. miRNA-ome plasma analysis unveils changes in blood-brain barrier integrity associated with acute liver failure in rats. Fluids Barriers CNS. 2023 Dec 8;20(1):92. doi: 10.1186/s12987-023-00484-7
- Szeliga M, Rola R. Conoidin A, a Covalent Inhibitor of Peroxiredoxin 2, Reduces Growth of Glioblastoma Cells by Triggering ROS Production. Cells2023, 12(15), 1934; https://doi.org/10.3390/cells12151934
- Czarnecka AM, Obara-Michlewska M, Wesół-Kucharska D, Greczan M, Kaczor M, Książyk J, Rokicki D, Zielińska M. S100B Protein but Not 3-Nitrotyrosine Positively Correlates with Plasma Ammonia in Patients with Inherited Hyperammonemias: A New Promising Diagnostic Tool? J Clin Med. 2023 Mar 21;12(6):2411. doi: 10.3390/jcm12062411.
- Pawlik M., Czarnecka A.M., Kołodziej M., Skowrońska K., Węgrzynowicz M., Podgajna M., Czuczwar S.J., Albrecht J. Attenuation of initial pilocarpine-induced electrographic seizures by methionine sulfoximine pretreatment tightly correlates with the reduction of the extracellular taurine in the hippocampus. Epilepsia, 2023, https://doi.org/10.1111/epi.17554
- Szeliga M, Rola R. Menadione potentiates auranofin-induced glioblastoma cell death. International Journal of Molecular Sciences. 2022 Dec 11;23(24):15712. doi: 10.3390/ijms232415712 publikacja oryginalna. Open access.
- Obara-Michlewska M, Szeliga M. Editorial for the Neurochemistry International Special Issue "The oxidative/nitrosative stress in brain tumors". Neurochem Int. 2022 Sep;158:105377. doi: 10.1016/j.neuint.2022.105377.
- Sowińska M, Szeliga M, Morawiak M, Zabłocka B, Urbanczyk-Lipkowska Z Design, Synthesis and Activity of New N1-Alkyl Tryptophan Functionalized Dendrimeric Peptides against Glioblastoma. Biomolecules. 2022 Aug 13;12(8):1116. doi: 10.3390/biom12081116.
- Milewski K., Orzeł‑Gajowik K, Zielińska M. Mitochondrial Changes in Rat Brain Endothelial Cells Associated with Hepatic Encephalopathy: Relation to the Blood–Brain Barrier Dysfunction. Neurochemical Research Published: https://doi.org/10.1007/s11064-022-03698-7
-
Zielińska M., Albrecht J., Popek M. Dysregulation of Astrocytic Glutamine Transport in Acute Hyperammonemic Brain Edema. Front Neurosci. 2022; 16: 874750. Published online 2022 Jun 6. doi: 10.3389/fnins.2022.874750
- Obara-Michlewska M. The tryptophan metabolism, kynurenine pathway and oxidative stress - implications for glioma pathobiology. Neurochem Int. 2022 Jun 3;158:105363. doi: 10.1016/j.neuint.2022.105363. Online ahead of print.
-
Popek M, Bobula B, Orzeł-Gajowik K, Zielińska M. The Effect of TGF-β1 Reduced Functionality on the Expression of Selected Synaptic Proteins and Electrophysiological Parameters: Implications of Changes Observed in Acute Hepatic Encephalopathy. Int J Mol Sci. 2022 Jan 19;23(3):1081. doi: 10.3390/ijms23031081.
- Szeliga M. Comprehensive analysis of the expression levels and prognostic values of PRDX family genes in glioma. Neurochem Int. 2021 Dec 28; 153:105256. doi: 10.1016/j.neuint.2021.105256.
- Mielcarska MB, Skowrońska K, Wyżewski Z, Toka FN. Disrupting Neurons and Glial Cells Oneness in the Brain-The Possible Causal Role of Herpes Simplex Virus Type 1 (HSV-1) in Alzheimer's Disease. Int J Mol Sci. 2021 Dec 27;23(1):242. doi: 10.3390/ijms23010242.
- Orzeł-Gajowik K, Milewski K, Zielińska M. Insight into microRNAs-Mediated Communication between Liver and Brain: A Possible Approach for Understanding Acute Liver Failure? Int J Mol Sci. 2021 Dec 25;23(1):224. doi: 10.3390/ijms23010224.
- Pawlik, M.J.; Aldana, B.I.; Belfiori-Carrasco, L.F.; Obara-Michlewska, M.; Popek, M.P.; Czarnecka, A.M.; Albrecht, J. Inhibition of Glutamate Release, but Not of Glutamine Recycling to Glutamate, Is Involved in Delaying the Onset of Initial Lithium-Pilocarpine-Induced Seizures in Young Rats by a Non-Convulsive MSO Dose. Int. J. Mol. Sci. 2021, 22, 11127. https://doi.org/10.3390/ijms222011127
- Dąbrowska K., Skowrońska K. , Popek M., Albrecht J. and Zielińska M. The Role of Nrf2 Transcription Factor and Sp1-Nrf2 Protein Complex in Glutamine Transporter SN1 Regulation in Mouse Cortical Astrocytes Exposed to Ammonia. Int. J. Mol. Sci. 2021, 22(20), 11233; https://doi.org/10.3390/ijms222011233 (registering DOI)
- Pawlik M. J., Miziak B.,Walczak A., Konarzewska A., Chrościńska-Krawczyk M.,Albrecht J. and Czuczwar S. J. Selected Molecular Targets for Antiepileptogenesis. Int. J. Mol. Sci. 2021, 22, 9737 https://doi.org/10.3390/ijms22189737
- Hamdani E. H., Popek M., Frontczak-Baniewicz M., Utheim T.P. , Albrecht J. Zielińska M. Chaudhry F. A. Perturbation of astroglial Slc38 glutamine transporters by NH4+ contributes to neurophysiologic manifestations in acute liver failure. The Faseb Journal 2021 doi: 10.1096/fj.202001712RR
- Milewski K. , Czarnecka A. M. , Albrecht J. and Zielińska M. Decreased Expression and Uncoupling of Endothelial Nitric Oxide Synthase in the Cerebral Cortex of Rats with Thioacetamide-Induced Acute Liver Failure. Int. J. Mol. Sci. 2021, 22, 6662. https://doi.org/10.3390/ijms22136662
- Sowińska M, Szeliga M, Morawiak M, Ziemińska E, Zabłocka B, Urbańczyk-Lipkowska Z. Peptide dendrimers with non-symmetric bola structure exert long term effect on glioblastoma and neuroblastoma cell lines. Biomolecules 2021, 11(3), 435; https://doi.org/10.3390/biom11030435.
- Szeliga M, Albrecht J. Roles of nitric oxide and polyamines in brain tumor growth. Adv Med Sci. 2021 Mar 9;66(1):199-205. doi: 10.1016/j.advms.2021.02.006
- Pawlik MJ, Obara-Michlewska M, Popek MP, Czarnecka AM, Czuczwar SJ, Łuszczki J, Kołodziej M, Acewicz A, Wierzba-Bobrowicz T, Albrecht J. Pretreatment with a glutamine synthetase inhibitor MSO delays the onset of initial seizures induced by pilocarpine in juvenile rats. Brain Res. 2021 Jan 7;147253. DOI: 10.1016/j.brainres.2020.147253
- Szeliga M. Peroxiredoxins in Neurodegenerative Diseases. Antioxidants (Basel). 2020 Nov 30;9(12):E1203. doi: 10.3390/antiox9121203 Praca przeglądowa. Forma dostępu: open acces.
- Czarnecka AM ,Milewski K, Albrecht J, Zielińska M. The Status of Bile Acids and Farnesoid X Receptor in Brain and Liver of Rats with Thioacetamide-Induced Acute Liver Failure. Int. J. Mol. Sci. 2020, 21(20), 7750; https://doi.org/10.3390/ijms21207750
- Szeliga M, Karpińska M, Rola R, Niewiadomy A. Design, synthesis and biological evaluation of novel 1,3,4-thiadiazole derivatives as anti-glioblastoma agents targeting the AKT pathway. Bioorg Chem. 2020 Oct 9;105:104362. doi: 10.1016/j.bioorg.2020.104362.
- Skowrońska K, Kozłowska H, Albrecht J. Neuron-derived factors negatively modulate ryanodine receptor-mediated calcium release in cultured mouse astrocytes. Cell Calcium. 2020. 92: 102304. doi: 10.1016/j.ceca.2020.102304
- Szeliga M. Thiadiazole derivatives as anticancer agents. Pharmacol Rep. 2020 Sep 3. doi:10.1007/s43440-020-00154-7
- Popek M, Bobula B, Sowa J, Hess G, Frontczak-Baniewicz M, Albrecht J, Zielińska M. Physiology and morphological correlates of excitatory transmission are preserved in glutamine transporter SN1- depleted mouse frontal cortex. Neuroscience 2020 August 26 https://doi.org/10.1016/j.neuroscience.2020.08.019
- Czarnecka AM, Hilgier W, Zielińska M. S-Adenosylmethionine Deficiency and Brain Accumulation of S-Adenosylhomocysteine in Thioacetamide-Induced Acute Liver Failure. Nutrients 2020, 12(7), 2135; https://doi.org/10.3390/nu12072135
- Czarnecka A, Zielińska M. Po co nam kwasy żółciowe w mózgu? KOSMOS 69, 1, 37–44, 2020 https://kosmos.ptpk.org/index.php/Kosmos/issue/view/150
- Obara-Michlewska M, Szeliga M. Targeting Glutamine Addiction in Gliomas. Cancers (Basel). 2020 Jan 29;12(2). Pii: E310. doi: 10.3390/cancers12020310.
- Milewski K, Bogacińska-Karaś M, Hilgier W, Albrecht J, Zielińska M. TNFα increases STAT3-mediated expression of glutaminase isoform KGA in cultured rat astrocytes. Cytokine. 2019 Jul 22;123:154774. doi: 10.1016/j.cyto.2019.154774.
- Albrecht J, Zielińska M. Exchange-mode glutamine transport across CNS cell membranes. Neuropharmacology 2019 Mar 8. Pii: S0028-3908(19)30081-4. Doi: 10.1016/j.neuropharm.2019.03.003.
- Majewska E, Márquez J, Albrecht J, Szeliga M. Transfection with GLS2 Glutaminase (GAB) Sensitizes Human Glioblastoma Cell Lines to Oxidative Stress by a Common Mechanism Involving Suppression of the PI3K/AKT Pathway. Cancers (Basel). 2019 Jan 19;11(1). Pii: E115. doi: 10.3390/cancers11010115.
- Skowrońska K, Obara-Michlewska M, Zielińska M, Albrecht J. NMDA Receptors in Astrocytes: In Search for Roles in Neurotransmission and Astrocytic Homeostasis. Int J Mol Sci. 2019 Jan 14;20(2). Pii: E309. doi: 10.3390/ijms20020309.
- Dąbrowska K, Zielińska M Silencing of Transcription Factor Sp1 Promotes SN1 Transporter Regulation by Ammonia in Mouse Cortical Astrocytes. Int J Mol Sci. 2019 Jan 9;20(2). Pii: E234. doi: 10.3390/ijms20020234.
- Skowrońska K, Obara-Michlewska M, Czarnecka A, Dąbrowska K, Zielińska M, Albrecht J. Persistent Overexposure to N-Methyl-D-Aspartate (NMDA) Calcium-Dependently Downregulates Glutamine Synthetase, Aquaporin 4, and Kir4.1 Channel in Mouse Cortical Astrocytes. Neurotox Res. 2019 Jan;35(1):271-280. doi: 10.1007/s12640-018-9958-3. Epub 2018 Sep 15.
- Czarnecka A, Aleksandrowicz M, Jasiński K, Jaźwiec R, Kalita K, Hilgier W, Zielińska M. Cerebrovascular reactivity and cerebral perfusion of rats with acute liver failure: role of L-glutamine and asymmetric dimethylarginine in L-arginine-induced response. J Neurochem. 2018 Dec;147(5):692-704. doi: 10.1111/jnc.14578. Epub 2018 Nov 6.
- Dąbrowska K, Albrecht J, Zielińska M. Protein kinase C-mediated impairment of glutamine outward transport and SN1 transporter distribution by ammonia in mouse cortical astrocytes. Neurochem Int. 2018 Sep;118:225-232. doi: 10.1016/j.neuint.2018.07.001. Epub 2018 Jul 3.
- Dabrowska K, Skowronska K, Popek M, Obara-Michlewska M, Albrecht J, Zielinska M. Roles of Glutamate and Glutamine Transport in Ammonia Neurotoxicity: State of the Art and Question Marks. Endocr Metab Immune Disord Drug Targets. 2018;18(4):306-315. doi: 10.2174/1871520618666171219124427.
- Obara-Michlewska M, Ding F, Popek M, Verkhratsky A, Nedergaard M, Zielinska M, Albrecht J. Interstitial ion homeostasis and acid-base balance are maintained in oedematous brain of mice with acute toxic liver failure. Neurochem Int. 2018 Sep;118:286-291. doi: 10.1016/j.neuint.2018.05.007. Epub 2018 May 14.
- Popek M, Bobula B, Sowa J, Hess G, Polowy R, Filipkowski RK, Frontczak-Baniewicz M, Zabłocka B, Albrecht J, Zielińska M. Cortical Synaptic Transmission and Plasticity in Acute Liver Failure Are Decreased by Presynaptic Events. Mol Neurobiol. 2018 Feb;55(2):1244-1258. doi: 10.1007/s12035-016-0367-4. Epub 2017 Jan 23.
- Milewski K, Bogacińska-Karaś M, Fręśko I, Hilgier W, Jaźwiec R, Albrecht J, Zielińska M. Ammonia Reduces Intracellular Asymmetric Dimethylarginine in Cultured Astrocytes Stimulating Its y⁺LAT2 Carrier-Mediated Loss. Int J Mol Sci. 2017 Nov 2;18(11). Pii: E2308. doi: 10.3390/ijms18112308.
- Majewska E, Rola R, Barczewska M, Marquez J, Albrecht J, Szeliga M. Transcription factor GATA3 expression is induced by GLS2 overexpression in a glioblastoma cell line but is GLS2-independent in patient-derived glioblastoma. J Physiol Pharmacol. 2017 Apr;68(2):209-214.
- Zielińska M, Aschner M. Enthusiasm Scientifically Oriented: The Preface for the Special Issue Dedicated to Jan Albrecht. Neurochem Res. 2017 Mar;42(3):711-712. doi: 10.1007/s11064-016-2164-x.
- Czarnecka A, Milewski K, Zielińska M. Asymmetric Dimethylarginine and Hepatic Encephalopathy: Cause, Effect or Association? Neurochem Res. 2017 Mar;42(3):750-761. doi: 10.1007/s11064-016-2111-x. Epub 2016 Nov 25.
- Majewska E, Szeliga M. AKT/GSK3β Signaling in Glioblastoma. Neurochem Res. 2017 Mar;42(3):918-924. doi: 10.1007/s11064-016-2044-4. Epub 2016 Aug 27.
- Czarnecka A, Milewski K, Jaźwiec R, Zielińska M. Intracerebral Administration of S-Adenosylhomocysteine or S-Adenosylmethionine Attenuates the Increases in the Cortical Extracellular Levels of Dimethylarginines Without Affecting cGMP Level in Rats with Acute Liver Failure. Neurotox Res. 2017 Jan;31(1):99-108. doi: 10.1007/s12640-016-9668-7. Epub 2016 Sep 8.
- Zielińska M, Dąbrowska K, Hadera MG, Sonnewald U, Albrecht J. System N transporters are critical for glutamine release and modulate metabolic fluxes of glucose and acetate in cultured cortical astrocytes: changes induced by ammonia. J Neurochem. 2016 Jan;136(2):329-38. Doi: 10.1111/jnc.13376. Epub 2015 Nov 10.
- Milewski K, Hilgier W, Fręśko I, Polowy R, Podsiadłowska A, Zołocińska E, Grymanowska AW, Filipkowski RK, Albrecht J, Zielińska M. Carnosine Reduces Oxidative Stress and Reverses Attenuation of Righting and Postural Reflexes in Rats with Thioacetamide-Induced Liver Failure. Neurochem Res. 2016 Feb;41(1-2):376-84. doi: 10.1007/s11064-015-1821-9. Epub 2016 Jan 22.
- Szeliga M, Ćwikła J, Obara-Michlewska M, Cichocki A, Albrecht J. Glutaminases in slowly proliferating gastroenteropancreatic neuroendocrine neoplasms/tumors (GEP-NETs): Selective overexpression of mRNA coding for the KGA isoform. Exp Mol Pathol. 2016 Feb;100(1):74-8. doi: 10.1016/j.yexmp.2015.11.017. Epub 2015 Nov 12.
- Szeliga M, Różycka A, Jędrak P, Barańska S, Janik P, Jamrozik Z, Albrecht J. Expression of RNAs Coding for Metal Transporters in Blood of Patients with Huntington’s Disease. Neurochem Res. 2016 Feb;41(1-2):101-6. doi: 10.1007/s11064-015-1737-4. Epub 2015 Oct 15.
- Szeliga M, Bogacińska-Karaś M, Kuźmicz K, Rola R, Albrecht J. Downregulation of GLS2 in glioblastoma cells is related to DNA hypermethylation but not to the p53 status. Mol 2016 Sep;55(9):1309-16. Doi: 10.1002/mc.22372. Epub 2015 Aug 10.
- Albrecht J, Zielińska M. Mechanisms of Excessive Extracellular Glutamate Accumulation in Temporal Lobe Epilepsy. Neurochem Res. 2017 Jun;42(6):1724-1734. doi: 10.1007/s11064-016-2105-8. Epub 2016 Nov 21.
- Milewski K, Oria M. What we know: the inflammatory basis of hepatic encephalopathy. Metab Brain Dis. 2016 Dec;31(6):1239-1247. Epub 2015 Oct 26.
- Jęśko H, Wilkaniec A, Cieślik M, Hilgier W, Gąssowska M, Lukiw WJ, Adamczyk A1.Altered Arginine Metabolism in Cells Transfected with Human Wild-Type Beta Amyloid Precursor Protein (βAPP). Curr Alzheimer Res. (2016) 13(9):1030-9.
- Zielińska M, Milewski K, Skowrońska M, Gajos A, Ziemińska E, Beręsewicz A, Albrecht J. Induction of inducible nitric oxide synthase expression in ammonia-exposed cultured astrocytes is coupled to increased arginine transport by upregulated y(+)LAT2 transporter. J Neurochem. 2015 Dec;135(6):1272-81. doi: 10.1111/jnc.13387. Epub 2015 Nov 6.
- Zieminska, A. Stafiej, B. Toczylowska B, J. Albrecht, MED. Łazarewicz. Role of Ryanodine and NMDA Receptors in Tetrabromobisphenol A-Induced Calcium Imbalance and Cytotoxicity in Primary Cultures of Rat Cerebellar Granule Cells. Neurotox Res. 2015 Oct;28(3):195-208. doi: 10.1007/s12640-015-9546-8.
- Milewski K, Hilgier W, Albrecht J, Zielińska M.The dimethylarginine (ADMA)/nitric oxide pathway in the brain and periphery of rats with thioacetamide-induced acute liver failure: Modulation by histidine. Neurochem Int. 2015 Sep;88:26-31. doi: 10.1016/j.neuint.2014.12.004. Epub 2014 Dec 15.
- Ruszkiewicz J, Albrecht J.Changes of the thioredoxin system, glutathione peroxidase activity and total antioxidant capacity in rat brain cortex during acute liver failure: modulation by L-histidine. Neurochem Res. 2015 Feb;40(2):293-300. doi: 10.1007/s11064-014-1417-9. Epub 2014 Aug 27.
- Szeliga M, Albrecht J Opposing roles of glutaminase isoforms in determining glioblastoma cell phenotype. Neurochem Int. 2015 Sep;88:6-9. doi: 10.1016/j.neuint.2014.11.004. Epub 2014 Dec 18.
- Ruszkiewicz J, Albrecht J Changes in the mitochondrial antioxidant systems in neurodegenerative diseases and acute brain disorders. Neurochem Int. 2015 Sep;88:66-72. doi: 10.1016/j.neuint.2014.12.012. Epub 2015 Jan 6.
- Obara-Michlewska M, Ruszkiewicz J, Zielińska M, Verkhratsky A, Albrecht J Astroglial NMDA receptors inhibit expression of Kir4.1 channels in glutamate-overexposed astrocytes in vitro and in the brain of rats with acute liver failure. Neurochem Int. 2015 Sep;88:20-5. doi: 10.1016/j.neuint.2014.10.006. Epub 2014 Oct 23.
- Albrecht J, Zielińska M. Deficit of astroglia-derived thrombospondin-1 and loss of synaptic proteins in hepatic encephalopathy: do ammonia-overexposed astrocytes derange the synaptic hardware? J Neurochem. 2014 Nov;131(3):265-7. doi: 10.1111/jnc.12823. Epub 2014 Aug 8.
- Zielińska M, Obara-Michlewska M, Hilgier W, Albrecht J.Citrulline uptake in rat cerebral cortex slices: modulation by Thioacetamide -Induced hepatic failure. Metab Brain Dis. 2014 Dec;29(4):1053-60. doi: 10.1007/s11011-013-9472-5. Epub 2014 Jan 3.
- Albrecht (2014) Ammonia. In: Aminoff M.J. and Daroff R.B. (eds.) Encyclopedia of the Neurological Sciences, 2nd edition, vol. 1, pp. 148-151. Oxford: Academic Press.
- Hilgier W, Kocki T, Obara-Michlewska M, Turski WA, Oja SS, Saransaari P, Albrecht J. Modulation by kynurenine of extracellular kynurenate and glutamate in cerebral cortex of rats with acute liver failure. Pharmacol Rep.2014 Jun;66(3):466-70. doi: 10.1016/j.pharep.2013.11.007. Epub 2014 Apr 13.
- Zielińska M, Popek M, Albrecht J. Roles of changes in active glutamine transport in brain edema development during hepatic encephalopathy: an emerging concept. Neurochem Res. 2014;39(3):599-604. doi: 10.1007/s11064-013-1141-x. Epub 2013 Sep 26.
- Martín-Rufián M, Nascimento-Gomes R, Higuero A, Crisma AR, Campos-Sandoval JA, Gómez-García MC, Cardona C, Cheng T, Lobo C, Segura JA, Alonso FJ, Szeliga M, Albrecht J, Curi R, Márquez J, Colquhoun A, Deberardinis RJ, Matés JM. Both GLS silencing and GLS2 overexpression synergize with oxidative stress against proliferation of glioma cells. J Mol Med. (Berl) 2014 Mar;92(3):277-90. doi: 10.1007/s00109-013-1105-2. Epub 2013 Nov 26.
- Szeliga M, Bogacińska-Karaś M, Różycka A, Hilgier W, Marquez J, Albrecht J. Silencing of GLS and overexpression of GLS2 genes cooperate in decreasing the proliferation and viability of glioblastoma cells. Tumour Biol. 2014 Mar;35(3):1855-62. doi: 10.1007/s13277-013-1247-4. Epub 2013 Oct 6.
- Obara-Michlewska M, Tuszyńska P, Albrecht J. Ammonia upregulates kynurenine aminotransferase II mRNA expression in rat brain: a role for astrocytic NMDA receptors? Metab Brain Dis. 2013 Jun;28(2):161-5. doi: 10.1007/s11011-012-9353-3. Epub 2012 Nov 8.
- Ruszkiewicz J, Fręśko I, Hilgier W, Albrecht J. Decrease of glutathione content in the prefrontal cortical mitochondria of rats with acute hepatic encephalopathy: prevention by histidine. Metab Brain Dis. 2013 Mar;28(1):11-4. doi: 10.1007/s11011-012-9342-6. Epub 2012 Oct 20.
- Skowrońska M, Albrecht J. Oxidative and nitrosative stress in ammonia neurotoxicity. Neurochem Int. 2013 Apr;62(5):731-7. doi: 10.1016/j.neuint.2012.10.013. Epub 2012 Nov 7.
- Szeliga M, Zgrzywa A, Obara-Michlewska M, Albrecht J.Transfection of a human glioblastoma cell line with liver-type glutaminase (LGA) down-regulates the expression of DNA-repair gene MGMT and sensitizes the cells to alkylating agents. J Neurochem. 2012 Nov;123(3):428-36. doi: 10.1111/j.1471-4159.2012.07917.x. Epub 2012 Sep 21.
- Juszczak M, Matysiak J, Szeliga M,Pożarowski P, Niewiadomy A, Albrecht J, Rzeski W. 2-Amino-1,3,4-thiadiazole derivative (FABT) inhibits the extracellular signal-regulated kinase pathway and induces cell cycle arrest in human non-small lung carcinoma cells. Bioorg Med Chem Lett. 2012 Sep 1;22(17):5466-9. doi: 10.1016/j.bmcl.2012.07.036. Epub 2012 Jul 20.
- Skowrońska M, Zielińska M,Wójcik-Stanaszek L, Ruszkiewicz J, Milatovic D, Aschner M, Albrecht J. Ammonia increases paracellular permeability of rat brain endothelial cells by a mechanism encompassing oxidative/nitrosative stress and activation of matrix metalloproteinases. J Neurochem. 2012 Apr;121(1):125-34. doi: 10.1111/j.1471-4159.2012.07669.x. Epub 2012 Feb 15.
- Zielińska M, Skowrońska M, Fręśko I, Albrecht J. Upregulation of the heteromeric y(+)LAT2 transporter contributes to ammonia-induced increase of arginine uptake in rat cerebral cortical astrocytes. Neurochem Int. 2012 Sep;61(4):531-5. doi: 10.1016/j.neuint.2012.02.021. Epub 2012 Feb 27.
- Skowrońska M, Albrecht J. Alterations of blood brain barrier function in hyperammonemia: an overview. Neurotox Res. 2012 Feb;21(2):236-44. doi: 10.1007/s12640-011-9269-4. Epub 2011 Aug 27.
- Hilgier W, Łazarewicz JW, Strużynska L, Frontczak-Baniewicz M, Albrecht J. Repeated exposure of adult rats to Aroclor 1254 induces neuronal injury and impairs the neurochemical manifestations of the NMDA receptor-mediated intracellular signaling in the hippocampus. 2012 Jan;33(1):16-22. doi: 10.1016/j.neuro.2011.10.005. Epub 2011 Oct 21.
Zakład Neuropeptydów
Kierownik Zakładu
Dr hab. n. med. (mgr farm.) Piotr Lipiński, email Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript. , tel. 22 60 86 480; pokój B-724
Pracownicy naukowi
Prof. dr hab. Aleksandra Misicka-Kęsik, email: Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., tel. 22 60 86 454
Dr n. med. Jolanta Dyniewicz, email: Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., tel. 22 60 86 480
Dr n. med. (lek. wet.) Piotr Kosson, email: Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., tel. 22 60 86 454
Dr n. med. Joanna Matalińska, email: Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., tel. 22 60 86 455/548
Dr n. biol. Patrycja Redkiewicz, email: Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., tel. 22 60 86 480
Doktoranci
Mgr Katarzyna Kosińska, email: Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., tel. 60 86 480
Profil badawczy
- Poszukiwanie nowych substancji czynnych o działaniu przeciwbólowym w bólu ostrym, przewlekłym i neuropatycznym.
- Poszukiwanie nowych substancji czynnych o działaniu przeciwnowotworowym.
Granty
- Radiofarmaceutyki oparte na antagonistach receptora tachykininowego-1 do diagnostyki i terapii nowotworu mózgu - glejaka wielopostaciowego, 2017/25/B/NZ7/01896, kierownik - prof. dr hab. Aleksandra Misicka-Kęsik, 2018-2021.
- Opracowanie modelu homologicznego receptora NK1 z wykorzystaniem danych o międzygatunkowych różnicach wiązalności ligandów, 2016/23/D/NZ7/0363, kierownik - dr Piotr F.J. Lipiński, 2017-2021.
Współpraca krajowa
- Wydział Chemii, Uniwersytet Warszawski, Warszawa
- Instytut Chemii i Techniki Jądrowej, Warszawa
- Narodowy Instytut Leków, Warszawa
- Uniwersytet Medyczny w Łodzi, Łódź
- Instytut Farmakologii im. Jerzego Maja, Kraków
Współpraca zagraniczna
- Biological Research Institute, Hungarian Academy of Sciences, Szeged, Węgry
- University of Arizona, Tucson, USA
Aparatura
- Zestaw preparatywny HPLC (Shimadzu)
- Zestaw HPLC sprzężony ze spektrometrem masowym (LC-MS, Shimadzu)
- Urządzenie filtracyjne 96-dołkowe (harvester) Microbeta Filtermat (Perkin Elmer)
- Urządzenie filtracyjne 24dołkowe (harvester) M-24 Cell Harvester (Brandel)
- Licznik scyntylacyjny i luminescencyjny (1450 LSC & Luminescence Counter, Wallac MicroBeta TriLux, Perkin Elmer)
Metody badawcze
- Synteza organiczna (peptydy i peptydomimetyki)
- Badania powinowactwa receptorowego metodami radioizotopowymi
- Badania in vitro aktywności cytotoksycznej i antyproliferacyjnej
- Badania in vivo aktywności przeciwbólowej w modelach bólu ostrego i przewlekłego
- Modelowanie molekularne oddziaływań receptor-ligand (dokowanie, dynamika molekularna)
Wybrane publikacje
- Halik, P.J.; Lipiński, P.F.J.; Matalińska, J.; Koźmiński, P.; Misicka, A.; Gniazdowska, E. Radiochemical Synthesis and Evaluation of Novel Radioconjugates of Neurokinin 1 Receptor Antagonist Aprepitant Dedicated for NK1R-Positive Tumors, Molecules, 2020, 25 3756.
- Dyniewicz, J.; Lipiński, P.F.J.; Kosson, P.; Bochyńska-Czyż, M.; Matalińska, J.; Misicka, A. Antinociceptive and cytotoxic activity of opioid peptides with hydrazone and hydrazide moieties at the C-terminus, Molecules, 2020, 25, 3429.
- Kowalczyk, A.; Lipiński, P.F.J.; Karoń, K.; Rode, J.E.; Lyczko, K.; Dobrowolski, J.Cz.; Donten, M.; Kaczorek, D.; Poszytek, J.; Kawęcki, R.; Łapkowski, M.; Malkowska, A.; Grudziński, I.P.; Nowicka, A.M. Enantioselective sensing of (S)-Thalidomide in blood plasma with a chiral naphthalene diimide derivative, Biosens Bioelectron, 2020, 167, 112446.
- Matalińska J.; Lipiński P.F.J.; Kotlarz A.; Misicka A. Antiproliferative effects of [D-Pro2, D-Trp7,9]-substance P and aprepitant on several cancer cell lines and their selectivity in comparison to normal cells, Folia Neuropathol, 2020, 3, in press.
- Tymecka, D., Lipiński, P.F.J.; Kosson, P.; Misicka, A. beta2-Homo-Amino Acid Scan of Mu-Selective Opioid Tetrapeptide TAPP,Molecules, 2020, 25, 2461
Adamska-Bartłomiejczyk, A.; Lipiński P.F.J.; Piekielna-Ciesielska, J.; Kluczyk, A.; Janecka, A Pharmacological profile and molecular modeling of cyclic opioid analogs incorporating various phenylalanine derivatives,ChemMedChem, 2020, 15. - Kokocinska-Kusiak, A.; Matalińska, J.; Sacharczuk, M.; Sobczyńska, M.; Góral-Radziszewska, K.; Wileńska, B.; Misicka, A.; Jezierski, T. Can mice be trained to discriminate urine odor of conspecifics with melanoma before clinical symptoms appear?J Vet Beh 2020 doi: 10.1016/j.jveb.2020.04.004
- Bochynska-Czyz, M.; Redkiewicz, P.; Kozlowska, H.; Matalinska, J.; Konop, M.; Kosson, P. Can keratin scaffolds be used for creating three-dimensional cell cultures?Open Medicine, 2020 15, 249 DOI: 10.1515/med-2020-0031
- Matalińska, J.; Lipiński, P.F.J.; Kotlarz, A.; Kosson, P.; Muchowska, A.; Dyniewicz, J. Evaluation of Receptor Affinity, Analgesic Activity and Cytotoxicity of a Hybrid Peptide, AWL3020.Int J Pept Res Ther. doi:10.1007/s10989-020-10051-5
- Fedorczyk, B.; Lipiński, P.F.J.; Puszko, A.K.; Tymecka, D.; Wilenska, B.; Dudka, W.; Perret, G.Y.; Wieczorek, R.; Misicka, A. Triazolopeptides Inhibiting the Interaction between Neuropilin-1 and Vascular Endothelial Growth Factor-165. Molecules 2019, 24, 1756.
- Lipiński, P.; Kosson, P.; Matalińska, J.; Roszkowski, P.; Czarnocki, Z.; Jarończyk, M.; Misicka, A.; Dobrowolski, J.; Sadlej, J. Fentanyl Family at the Mu-Opioid Receptor: Uniform Assessment of Binding and Computational Analysis.Molecules 2019, 24, 740.
- Lipiński, P.F.J.; Szűcs, E.; Jarończyk, M.; Kosson, P.; Benyhe, S.; Misicka, A.; Dobrowolski, J.C.; Sadlej, J. Affinity of fentanyl and its derivatives for the σ 1 -receptor.Medchemcomm 2019, 10, 1187.
- Lipiński, P.F.J.; Jarończyk, M.; Dobrowolski, J.C.; Sadlej, J. Molecular dynamics of fentanyl bound to μ-opioid receptor. Mol. Model. 2019, 25, 144.
- Wilenska, B.; Tymecka, D.; Włodarczyk, M.; Sobolewska-Włodarczyk, A.; Wiśniewska-Jarosińska, M.; Dyniewicz, J.; Somogyi, Á.; Fichna, J.; Misicka, A. Enkephalin degradation in serum of patients with inflammatoryboweldiseases. Reports 2019, 71, 42.
- Zatorski, H.; Salaga, M.; Zielińska, M.; Wasilewski, A.; Misicka, A.; Sacharczuk, M.; Fichna, J. High activity of endogenous opioid system protects against gastric damage development in mouse models of gastric mucosal injury. Reports 2019, 71, 218.
- Puszko, A.K.; Sosnowski, P.; Pułka-Ziach, K.; Hermine, O.; Hopfgartner, G.; Lepelletier, Y.; Misicka, A. Urea moiety as amide bond mimetic in peptide-like inhibitors of VEGF-A165/NRP-1 complex. Med. Chem. Lett. 2019, 29, 2493.
- Puszko, A.K.; Sosnowski, P.; Tymecka, D.; Raynaud, F.; Hermine, O.; Lepelletier, Y.; Misicka, A. Neuropilin-1 peptide-like ligands with proline mimetics, tested using the improved chemiluminescence affinity detection method.Medchemcomm 2019, 10, 332.
- Sowinska, M.; Morawiak, M.; Bochyńska-Czyż, M.; Lipkowski, A.; Ziemińska, E.; Zabłocka, B.; Urbanczyk-Lipkowska, Z. Molecular Antioxidant Properties and In Vitro Cell Toxicity of the p-AminobenzoicAcid (PABA) Functionalized Peptide Dendrimers.Biomolecules 2019, 9, 89.
- Ciechanowicz, P.; Rakowska, A.; Sikora, M.; Rudnicka, L. JAK-inhibitors in dermatology: current evidence and future applications. Dermatolog. Treat. 2019, 30, 648.
- Muchowska, A.; Redkiewicz, P., Różycki K., Matalińska J.; Lipiński PFJ.; Czuwara J.; Kosson P. The analgesic hybrid of dermorphin/substance P and analog of enkephalin improve wound healing in streptozotocin-induced diabetic rats.WoundRepair Regen. 2019, doi:10.1111/wrr.12775.
- Konop, M.; Kłodzińska E.; Borowiec J.; Laskowska AK.; Czuwara J; Konieczka P.; Cieślik B.; Waraksa E.; Rudnicka L. Application of micellar electrokinetic chromatography for detection of silver nanoparticles released from wound dressing.2019, 40, 1565.
Zakład Neurobiologii Naprawczej
Kierownik
dr hab. Joanna Sypecka, prof. IMDiK, tel. 22 60 86 510, 60 86 508, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript. ; pokój B-123
Sekretariat
Krystyna Wąsik, tel. 22 60 86 510, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript. ; pokój B-126
Pracownicy naukowi
dr hab. Małgorzata Nałęcz tel. 22 60 86 532,Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript..pl
dr hab. Luiza Stanaszek tel. 22 60 86 532, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Sylwia Dąbrowska tel. 22 60 86 471, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Justyna Janowska tel. 22 60 86 448,Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Justyna Gargaś tel. 22 60 86 448, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Pracownicy techniczni
Halina Zając tel. 22 60 86 531
Doktoranci
mgr Michał Frańczak, tel. 22 60 86 529, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr Paulina Gębala tel. 22 60 86 471, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr Weronika Maksymiuk tel. 22 60 86 529, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr Paulina Pawelec tel. 22 60 86 618, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr Karolina Ziąbska tel. 22 60 86 618, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Profil badawczy
Badania prowadzone w Zakładzie Neurobiologii Naprawczej mają na celu określenie podłoża i przebiegu wybranych chorób neurologicznych oraz opracowywanie potencjalnych strategii terapeutycznych z użyciem somatycznych komórek macierzystych. Przedmiotem naszych zainteresowań są mezenchymalne komórki macierzyste pochodzące ze szpiku kostnego ludzi i zwierzęce komórki glejowe. Główne zagadnienia badawcze dotyczą:
- oceny efektywności przeszczepu ludzkich progenitorów glejowych w modelu stwardnienia zanikowego bocznego (ALS) u myszy
- wyjaśnienia roli acetylacji/deacetylacji histonów w stymulacji endogennej neurogenezy w modelu asfiksji okołoporodowej
- zbadania procesu dojrzewania oligodendrocytów oraz przebiegu procesów mielinizacji w modelach wybranych chorób hypo/demielinizacyjnych
- ewaluacji wybranych mechanizmów interakcji neuron-glej oraz między poszczególnymi typami komórek glejowych w OUN
- procesów regeneracji tkanki nerwowej szczura w następstwie cytotoksycznego uszkodzenia tkanki z zastosowaniem inhibitora pompy sodowo-potasowej (ouabainy) po transplantacji ludzkich komórek mezenchymalnych szpiku kostnego
Granty
-
Rola oddziaływań międzykomórkowych w przebiegu procesów neurodegeneracyjnych po uszkodzeniach OUN, projekt statutowy nr 6, kierownik: dr hab. Joanna Sypecka
- Immunomodulacja oddziaływań mikroglej-oligodendrocyty jako strategia zapobiegająca rozwojowi uszkodzeń istoty białej mózgu w okresie okołoporodowym. (2024-2027), projekt NCN PRELUDIUM 22, kierownik: dr Justyna Gargaś
-
Ocena potencjału immunomodulacyjnego i regeneracyjnego komórek glejowych różnicowanych z ludzkich mezenchymalnych komórek macierzystych galarety Whartona w modelach wybranych schorzeń neurorozwojowych. (2023-2027), projekt NCN PRELUDIUM BIS, kierownik: dr hab. Joanna Sypecka
-
OLIGOPHAGY: Ocena roli procesu autofagii w komórkach oligodendrocytarnych w okołoporodowym hikopsyjno-ischemicznym uszkodzeniu mózgu (2022-2025), 2021/03/Y/NZ4/00214 (WEAVE UNISONO, we współpracy polsko-szwajcarskiej), kierownik dr hab. Joanna Sypecka
STRONA PROJEKTU:

-
Innowacyjne strategie terapeutyczne z zastosowaniem pęcherzyków zewnątrzkomórkowych pochodzących z mezenchymalnych komórek macierzystych w stwardnieniu zanikowym bocznym, (2022- 2023), projekt NAWA nr BPN/BKK/2021/1/00001, Komponent Krajowy im. Mieczysława Bekkera 2021, kierownik: dr Sylwia Dąbrowska
-
Czynniki indukowane hipoksją a zaburzenia dojrzewania oligodendrocytów w modelu asfiksji neonatalnej in vitro, (2019 –2023), nr 1494/NZ3/N/31/2018 (PRELUDIUM 16), kierownik: mgr Justyna Janowska
-
Inhibitory deacetylaz histonów, jako potencjalne czynniki modelujące reakcję zapalną indukowaną w mózgu po neonatalnej asfiksji u szczurów, (2018 – 2023), nr 00582/NZ3/B/27/2017 (OPUS 17), kierownik: dr hab. Małgorzata Nałęcz
-
Nadekspresja neureguliny-1 w progenitorach gleju (GRPs), jako metoda zwiększenia właściwości funkcjonalnych GRP, (2018–2023), projekt NCN nr 00721/NZ3/D/26/2017 (SONATA 13), kierownik: dr Luiza Stanaszek
-
Analiza interakcji mezenchymalnych komórek macierzystych oraz nowotworowych komórek macierzystych glejaka wielopostaciowego, (2020–2022), projekt NCN nr 2020/04/X/NZ3/00008 (MINIATURA 4), kierownik: dr Anna Andrzejewska
-
Rola zmian w funkcjonowaniu oligodendrocytów w patogenezie zaburzeń istoty białej będących skutkiem asfiksji neonatalne, (2020 – 2022), projekt NCN nr 2020/36/T/N24/00144 (ETIUDA 8), kierownik: mgr Justyna Janowska
Współpraca krajowa
- Uniwersytet Warszawski, Wydział Biologii, Warszawa
- Uniwersytet Warszawski, Centrum Nowych Technologii, Warszawa
- Politechnika Warszawska, Zakład Inżynierii Fotonicznej Instytutu Mikromechaniki i Fotoniki, Wydziału Mechatroniki, Warszawa
- SGGW, Instytut Medycyny Weterynaryjnej, Katedra Nauk Przedklinicznych
- Uniwersytet w Toruniu, Wydział Nauk Biologicznych i Weterynaryjnych, Katedra Fizjologii Zwierząt i Neurobiologii
Współpraca zagraniczna
- Department of Neuroscience, Biomedicine and Movement Sciences, University of Verona, Verona, Włochy
- Département des Neurosciences Fondamentales, Université de Lausanne, Szwajcaria
- NeuroDiderot, Université de Paris, Inserm, Paris, Francja
- Perinatal Center, Institute of Neuroscience and Physiology, Sahlgrenska Academy, University of Gothenburg, Gothenburg, Szwecja
- Department of Diagnostic Radiology and Nuclear Medicine, University of Maryland, Baltimore, Baltimore, MD, USA
- 3B’s Group, University of Minho, Braga, Portugalia
Aparatura
- System do obrazowania żeli (G-Box Chemi XR5 Syngene)
- Termocykler z blokiem grzejnym (Eppendorf)
- Aparat real-time PCR (Applied Biosystems)
- Spektrofotometr typu NanoDrop ((Termo-Scientific)
- Cytowirówka (Shandon Cytospin 4)
- Wirówka laboratoryjna (Eppendorf Centrifuge 5430R)
- Elektroporator (Bio-RAD CE Module + Gene Pulser Xcell)
- Komory laminarne
- Inkubatory do hodowli komórek
- Zamrażarka niskotemperaturowa
- Aparat stereotaktyczny dla szczurów wraz z adapterem dla myszy (Stoelting)
- Pochłaniacz oparów gazów do anestezji (Stoelting)
- Inkubator do indukcji hipoksji u zwierząt
- Pompa do mikroiniekcji
- Mikroskop operacyjny (Carl Zeiss OPMI pico)
Metody badawcze
- in vitro: hodowle komórkowe pierwotne ludzkich komórek mezenchymalnych szpiku kostnego oraz szczurzych i mysich komórek glejowych
- ex vivo: hodowle organotypowe skrawków mózgów szczurzych oraz skrawków hipokampa
- in vivo: modele zwierzęce, w tym model cytotoksycznego uszkodzenia mózgu indukowany ouabainą; model asfiksji okołoporodowej oraz model demielinizacji OUN - ALS (myszy rag2/shi )
- izolowanie mikropęcherzyków z ludzkich macierzystych komórek mezenchymalnych szpiku kostnego
- znakowanie komórek barwnikami przyżyciowymi (SPIO, GFP, CMFDA, PKH26)
- ocena zdolności funkcjonalnych komórek do przepływu, adhezji i migracji w warunkach in vitro z zastosowaniem specjalistycznych komór i videomikroskopii
- metody biochemiczne, w tym: elektroforeza, ELISA, LUMINEX, cytometria przepływowa, Western blot, zymografia in situ, ocena metylacji i acetylacji chromatyny
- metody biologii molekularnej: transfekcje mRNA i DNA do komórek; fuzja z białkiem GFP; RT- PCR, qRT-PCR
- transplantacja komórek u gryzoni drogą bezpośredniej infuzji do mózgu, zbiornika wielkiego, rdzenia kręgowego lub podania systemowego (dożylna, dotętnicza),
- techniki immunocytochemiczne oraz immunohistochemiczne
Patenty
- HYDROGEL COMPRISING MANGANES, METHODS AND USES THEREOF, Application No/Patent No 17209876.6 – 1109 (zgłoszenie patentowe)
- ZASTOSOWANIE MIKROPĘCHERZYKÓW POCHODZĄCYCH Z KOMÓREK MACIERZYSTYCH W LECZENIU STANU ZAPALNEGO MÓZGU, ZWŁASZCZA WYWOŁANEGO UDAREM, numer P.425 406, International Application No PCT/PL2019/050027 (zgłoszenie patentowe)
Wybrane publikacje
Janowska J, Gargas J, Zajdel K, Wieteska M, Lipinski K, Ziemka-Nalecz M, Frontczak-Baniewicz M, Sypecka J. Oligodendrocyte progenitor cells' fate after neonatal asphyxia-Puzzling implications for the development of hypoxic-ischemic encephalopathy. Brain Pathol. 2024 Mar 19:e13255. doi: 10.1111/bpa.13255.
Rogujski P, Lukomska B, Janowski M, Stanaszek L Glial-restricted progenitor cells: a cure for diseased brain? Biol Res. 2024 Mar 12;57(1):8. doi: 10.1186/s40659-024-00486-1
Gargas J, Janowska J, Gebala P, Maksymiuk W, Sypecka J. Reactive Gliosis in Neonatal Disorders: Friend or Foe for Neuroregeneration? Cells. 2024 Jan 11;13(2):131. doi: 10.3390/cells13020131
Andrzejewska A, Grzela R, Stankiewicz-Drogon A, Rogujski P, Nagaraj S, Darzynkiewicz E, Lukomska B, Janowski M. Mesenchymal stem cell engineering by ARCA analog-capped mRNA. Mol Ther Nucleic Acids. 2023 Jul 17;33:454-468. doi: 10.1016/j.omtn.2023.07.006.
Janowska J, Gargas J, Sypecka J. Pearls and Pitfalls of Isolating Rat OPCs for In Vitro Culture with Different Methods. Cell Mol Neurobiol. 2023 Jul 5. doi: 10.1007/s10571-023-01380-2.
Palasz E, Wilkaniec A, Stanaszek L, Andrzejewska A, Adamczyk A. Glia-Neurotrophic Factor Relationships: Possible Role in Pathobiology of Neuroinflammation-Related Brain Disorders. Int J Mol Sci. 2023 Mar 28;24(7):6321. doi: 10.3390/ijms24076321.
Vieira S, Strymecka P. Stanaszek L., Silva-Correia J., Drela K. , Fiedorowicz M. ,Malysz-Cymborska I. , Janowski M., Reis RL, Lukomska B., Walczak P., Oliveira JM. Mn-Based Methacrylated Gellan Gum Hydrogels for MRI-Guided Cell Delivery and Imaging. Bioengineering 28 Mar 2023;10(4), 427; https://doi.org/10.3390/bioengineering10040427
Ziemka-Nalecz M., Pawelec P. Ziabska K, Zalewska T: Sex Differences in Brain Disorders Int. J. Mol. Sci. 2023, 24(19), 14571; https://doi.org/10.3390/ijms241914571
Zajdel K, Janowska J, Frontczak-Baniewicz M, Sypecka J, Sikora B. Upconverting Nanoparticles as a New Bio-Imaging Strategy-Investigating Intracellular Trafficking of Endogenous Processes in Neural Tissue. Int J Mol Sci. 2023 Jan 6;24(2):1122. doi: 10.3390/ijms24021122.
Zalewska, T.; Pawelec, P.; Ziabska, K.; Ziemka-Nalecz, M. Sexual Dimorphism in Neurodegenerative Diseases and in Brain Ischemia. Biomolecules 2023, 13, 26. https://doi.org/10.3390/biom13010026
Gargas J, Janowska J, Ziabska K, Ziemka-Nalecz M, Sypecka J. Neonatal Rat Glia Cultured in Physiological Normoxia for Modeling Neuropathological Conditions In Vitro. Int J Mol Sci. 2022 May 26;23(11):6000. doi: 10.3390/ijms23116000
Araszkiewicz AM, Oliveira EP, Svendsen T, Drela K, Rogujski P, Malysz-Cymborska I, Fiedorowicz M, Reis RL, Oliveira JM, Walczak P, Janowski M, Lukomska B, Stanaszek L. Manganese-Labeled Alginate Hydrogels for Image-Guided Cell Transplantation. Int J Mol Sci. 2022 Feb 23;23(5):2465
Dabrowska S, Andrzejewska A, Janowski M, Lukomska B. Immunomodulatory and Regenerative Effects of Mesenchymal Stem Cells and Extracellular Vesicles: Therapeutic Outlook for Inflammatory and Degenerative Diseases. Front Immunol. 2021 Feb 5;11:591065. doi: 10.3389/fimmu.2020.591065
Dabrowska S, Andrzejewska A, Kozlowska H, Strzemecki D, Janowski M, Lukomska B. Neuroinflammation evoked by brain injury in a rat model of lacunar infarct. Exp Neurol. 2021 Feb;336:113531. doi: 10.1016/j.expneurol.2020.113531
Stanaszek L, Majchrzak M, Drela K, Rogujski P, Sanford J, Fiedorowicz M, Gewartowska M, Frontczak-Baniewicz M, Walczak P, Lukomska B, Janowski M. Myelin-Independent Therapeutic Potential of Canine Glial-Restricted Progenitors Transplanted in Mouse Model of Dysmyelinating Disease. Cells. 2021 Nov 1;10(11):2968.
Ziabska K, Ziemka-Nalecz M, Pawelec P, Sypecka J, Zalewska T. Aberrant Complement System Activation in Neurological Disorders. Int J Mol Sci. 2021 Apr 28;22(9):4675
Nowak B, Rogujski P, Janowski M, Lukomska B, Andrzejewska A. Mesenchymal stem cells in glioblastoma therapy and progression: How one cell does it all. Biochim Biophys Acta Rev Cancer. 2021 Aug;1876(1):188582.
Andrzejewska A, Dabrowska S, Lukomska B, Janowski M. Mesenchymal Stem Cells for Neurological Disorders. Adv Sci (Weinh). 2021 Feb 24;8(7):2002944.
Pawelec P, Ziemka-Nalecz M, Sypecka J, Zalewska T. The Impact of the CX3CL1/CX3CR1 Axis in Neurological Disorders. Cells. 2020 Oct 13;9(10):2277.
Janowska J, Gargas J, Ziemka-Nalecz M, Zalewska T, Sypecka J. Oligodendrocyte Response to Pathophysiological Conditions Triggered by Episode of Perinatal Hypoxia-Ischemia: Role of IGF-1 Secretion by Glial Cells. Mol Neurobiol. 2020;57(10):4250-4268 DOI:10.1007/s12035-020-02015-z.
Drela K, Stanaszek L, Snioch K, Kuczynska Z, Wrobel M, Sarzynska S, Legosz P, Maldyk P, Lukomska B. Bone marrow-derived from the human femoral shaft as a new source of mesenchymal stem/stromal cells: an alternative cell material for banking and clinical transplantation. Stem Cell Res Ther. 2020;11(1):262. DOI:10.1186/s13287-020-01697-5.
Zalewska T, Jaworska J, Sypecka J, Ziemka-Nalecz M. Impact of a Histone Deacetylase Inhibitor-Trichostatin A on Neurogenesis after Hypoxia-Ischemia in Immature Rats. Int J Mol Sci. 2020;21(11):3808. DOI:10.3390/ijms21113808.
Andrzejewska A, Dabrowska S, Nowak B, Walczak P, Lukomska B, Janowski M. Mesenchymal stem cells injected into carotid artery to target focal brain injury home to perivascular space. Theranostics. 2020;10(15):6615-6628. DOI: 10.7150/thno.43169.
Dabrowska S, Andrzejewska A, Strzemecki D, Muraca M, Janowski M, Lukomska B. Human bone marrow mesenchymal stem cell-derived extracellular vesicles attenuate neuroinflammation evoked by focal brain injury in rats. J Neuroinflammation. 2019 ;16(1):216. DOI:1186/s12974-019-1602-5.
Andrzejewska A, Nowakowski A, Grygorowicz T, Dabrowska S, Orzel J, Walczak P, Lukomska B, Janowski M. Single-cell, high-throughput, real-time in vitro analysis of mRNA-ITGA4-engineered mesenchymal stem cell docking to inflamed endothelium in a microfluidic model with validation in animals with focal brain injury. JCBF&M. 2019; 39:11:2308-2320. DOI:10.1177/0271678X18805238.
Andrzejewska A, Jablonska A, Podobinska M, Dabrowska S, Janowski M, Walczak P, Lukomska B. Labeling of human mesenchymal stem cells with different classes of vital stains: robustness and toxicity. Stem Cell Res Ther. 2019;10(1):187. DOI:10.1186/s13287-019-1296-8.
Dabrowska S, Andrzejewska A, Lukomska B, Janowski M. Neuroinflammation as a target for treatment of stroke using mesenchymal stem cells and extracellular vesicles. J Neuroinflammation. 2019;16(1):178. DOI:10.1186/s12974-019-1571-8.
Drela K, Nowakowski A, Stanaszek L, Kuczynska Z, Lukomska B. Experimental strategies of mesenchymal stem cells propagation - adverse events and potential risk of functional changes. Stem Cells Int. 2019;7012692. DOI:10.1155/2019/7012692.
Lukomska B, Stanaszek L, Zuba-Surma EK, Legosz P, Sarzynska S, Drela K. Challenges and Controversies in Human Mesenchymal Stem Cells Therapy. Stem Cells Int. 2019;9628536.
Andrzejewska A, Lukomska B, Janowski M. Mesenchymal stem cells: from roots to boost. Stem Cells. 2019; 37(7):855-864. DOI:10.1186/s13287-019-1296-8.
Majchrzak M, Drela K, Andrzejewska A, Figurska S, Rogujski P, Fiedorowicz M, Walczak P, Janowski M, Lukomska B, Stanaszek L. A variable hSOD1 copy number influences the phenotypic outcome of SOD1/rag2 mice - immunocompetent model of ALS. Sci Rep. 2019;9(1):799. DOI:10.1038/s41598-018-37235-w.
Janowska J, Gargas J, Ziemka-Nalecz M, Zalewska T, Buzanska L, Sypecka J. Directed glial differentiation and transdifferentiation for neural tissue regeneration. Exp Neurol. 2019; 319:112813. DOI:10.1016/j.expneurol.2018.08.010.
Jaworska J, Zalewska Z, Sypecka J, Ziemka-Nalecz M. Effect of HDAC inhibitor, Sodium butyrate, on neurogenesis in a rat model of neonatal hypoxia-ischemia. Potential mechanism of action. Mol Neurobiol. 2019;56(9):6341-6370. DOI:10.1007/s12035-019-1518-1
Dabrowska S, Sypecka J, Jablonska, Strojek L, Wielgos M, Domanska-Janik K, Sarnowska A. Neuroprotective Potential and Paracrine Activity of Stromal Vs. Culture-Expanded hMSC Derived from Wharton Jelly under Co-Cultured with Hippocampal Organotypic Slices. Mol Neurobiol. 2018;55(7):6021-6036.
Dabrowska S, Del Fattore A, Karnas E, Frontczak-Baniewicz, Kozlowska H, Muraca M, Janowski M, Lukomska B. Imaging of extracellular vesicles derived from human bone marrow mesenchymal stromal cells using fluorescent and magnetic labels. Int J Nanomedicine. 2018;13:1653-1664.
Janowska J, Sypecka J. Therapeutic Strategies for Leukodystrophic Disorders Resulting from Perinatal Asphyxia: Focus on Myelinating Oligodendrocytes. Mol Neurobiol. 2018;55(5):4388-4402.
Janowska J, Gargas J, Ziemka-Nalecz M, Zalewska T, Buzanska L, Sypecka J. Directed glial differentiation and transdifferentiation for neural tissue regeneration. Exp Neurol. 2018.DOI:S0014-4886(18)30401-1.
Ziemka-Nalecz M, Jaworska J, Sypecka J, Zalewska T. Histone deacetylase inhibitors: a therapeutic key in neurological disorders? J Neuropathol Exp Neurol. 2018;77(10):855-870.
Ziemka-Nalecz M, Janowska J, Strojek L, Jaworska J, Zalewska T, Frontczak-Baniewicz M, Sypecka J. Impact of neonatal hypoxia-ischemia on oligodendrocyte survival, maturation and myelinating potential. J Cellular Mol Med. 2018;22(1):207-222.
Janowska J, Ziemka-Nalecz M, Sypecka J. Differentiation of rat oligodendroglial cells is highly influenced by oxygen tension: in vitro model mimicking physiologically normoxic conditions. Int J Mol Sci. 2018;24:19(2):331.
Nowakowski A, Andrzejewska A, Boltze J, Nitzsche F, Cui L, Jolkkonen J, Walczak P, Lukomska B, Janowski M. Translation, but not transfection limits clinically relevant, exogenous mRNA based induction of alpha-4 integrin expression on human mesenchymal stem cells. Sci Rep. 2017:7(1):1103.
Ziemka-Nalecz M, Jaworska J, Zalewska T. Insights into the neuroinflammatory responces after neonatal hypoxia-ischemia. J Neuropath Exp Neurology. 2017; 76(8):644-654.
Ziemka-Nalecz M, Jaworska J, Sypecka J, Polowy R, Filipkowski R, Zalewska T. Sodium butyrate, a histone deacetylase inhibitor, exhibits neuroprotective/neurogenic effects in a rat model of neonatal hypoxia –ischemia. Mol Neurobiol. 2017;54(7):5300-5318.
Jaworska J, Ziemka-Nalecz M, Sypecka J, Zalewska T. The potential neuroprotective role of histone deacetylase inhibitor Sodium Butyrate after neonatal hypoxia-ischemia. J Neuroinflammation. 2017;14(1):34.
Sypecka J, Ziemka-Nalecz M, Dragun-Szymczak P, Zalewska T. A simple, xeno-free method for oligodendrocyte derivation from human neural stem cells derived from umbilical cord: engagement of gelatinases in the cell commitment and differentiation. J Tissue Eng Regen Med. 2017;11(5):1442-1455.
Zakład Neurochemii
Kierownik:
prof. dr hab. Elżbieta Salińska; 22 608 6528; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., pokój B-402
Pracownicy naukowi:
• dr hab. Elżbieta Ziemińska, profesor IMDiK PAN; 22 608 6533; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., pokój B-428
• dr inż. Justyna Augustyniak; 22 608 6534; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., pokój B-404
• dr inż. Ewelina Bratek-Gerej; 22 608 6534; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., pokój B-404
• dr Damian Mielecki; 22 6086534; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., pokój B-404
Pracownicy techniczni:
mgr Jakub Fiedorowicz; 22 6086 534; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., pokój B-404
Sekretariat:
mgr Aleksandra Stafiej; 22 608 6528; Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript., pokój. B-401
Profil badawczy:
Rola naturalnych procesów adaptacyjnych oraz egzo- i endogennych substancji o potencjale neuroprotekcyjnym w prewencji, diagnostyce i terapii chorób neurodegeneracyjnych.
- Poszukiwanie mechanizmów uszkodzenia mózgu spowodowanego niedokrwieniem, oraz skutecznych metod neuroprotekcji
- Badania nad molekularnymi mechanizmami uczenia się i zapamiętywania, ze szczególnym uwzględnieniem roli neurotransmisji glutaminianergicznej oraz aktywowanych kanałów przepuszczalnych dla jonów wapnia
- Wykorzystanie analiz ekspresji genów (RT-qPCR, RNA-seq) w badaniach zmian neurorozwojowych indukowanych przez leki oraz substancje neurotoksyczne w modelach komórkowych oraz zwierzęcych
- Zastosowanie analizy profili metabolicznych do oceny mechanizmów działania czynników środowiskowych oraz leków w modelach komórkowych i zwierzęcych (badania we współpracy z IBIB PAN)
- Ocena mechanizmów powstawania i rozwoju zmian chorobowych na poziomie metabolomu u ludzi (badania we współpracy z IBIB PAN)
Metody badawcze:
• mikrodializa mózgu szczura
• perfuzja mózgu szczura
• hipobaria i hiperbaria tlenowa i powietrzna
• obrazowanie w mikroskopie fluorescencyjnym, konfokalnym
• ocena powinowactwa (wiązania) ligandów
• oznaczanie aktywności enzymów antyoksydacyjnych metodą ELISA
• oznaczanie apoptozy (TUNEL)
• analiza ekspresji białek metodą Western blot
• izolacja kwasów nukleinowych (RNA, DNA)
• analiza ekspresji genów: PCR, RT- PCR, qRT-PCR, RNA-seq
• analiza profili metabolicznych: spektroskopia NMR
Stosowane modele badawcze:
in vivo
model asfiksji okołoporodowej u 7-dniowych osesków szczurzych
model globalnej ischemii u myszoskoczków
model pasywnego unikania bodźców smakowych na 1-dniowych kurczętach
in vitro
hodowla pierwotna komórek ziarnistych móżdżku szczura
hodowle progenitorów neuralnych oraz komórek śródbłonka naczyniowego otrzymanych poprzez różnicowanie komórek hiPSCs
organoidy mózgowe i naczyniowe
Aparatura:
• aparat stereotaktyczny, zestaw do mikrodializy małych zwierząt laboratoryjnych
• system do perfuzji ciągłej
• zestaw anestezjologiczny do operacji na małych zwierzętach
• komora hipobaryczna oraz komora hiperbaryczna
• ultrawirówka preparacyjna Optima XPN Series (Beckman)
• densytometr ImageScanner III Labscan 6.0 (GE Healtcare) z oprogramowaniem
• kriostat Leica
• mikrotom
• aparaty do elektroforezy białek (WB)
• wielofunkcyjny czytnik mikropłytek FLUOstar Omega - fluorymetr, luminometr i spektrofotometr (BMG Labtech); ex: 340,390,405,440,485,530,590; em: 340,485,510,520,580,620 nm
• czytnik mikropłytek FLUOROSKAN FL- fluorymetr, luminometr (Labsystems); ex: 400,440,485,530,544; em: 485,520,527,538,590,620 nm
• homogenizator tkankowy
• spektrofotometr do pomiaru ilości kwasów nukleinowych, Denovix DS11
• termocykler: Civic Cycer II (Biotach, INC)
• lightcycler 96 (Roche)
Współpraca krajowa:
• Instytut Farmakologii PAN, Kraków
• Instytut Biocybernetyki i Inżynierii Biomedycznej PAN, Warszawa
• Instytut Biochemii i Biofizyki PAN, Warszawa
• Instytut Chemii Organicznej PAN, Warszawa
• Uniwersytet Warszawski, Warszawa
Współpraca zagraniczna:
• University at Buffalo, The State University of New York, NY, USA;
• Sathyabama Institute of Science and Technology, Chennai, Indie
• University of Milan, Mediolan, Włochy
Granty badawcze:
• Badanie mechanizmów neuroprotekcyjnego działania agonistów receptorów metabotropowych grupy II (mGluR2/3) w modelowej asfiksji okołoporodowej noworodków szczura.- finansowany przez NCN ( DEC- 2016/23/N/NZ7/01942), kierownik projektu: mgr inż. Ewelina Bratek (2017-2019) https://projekty.ncn.gov.pl/index.php?projekt_id=355361
• Badanie ekspresji genów potencjalnie uczestniczących w patogenezie autyzmu w dwóch modelach zwierzęcych: walproinianowym i talidomidowym. – finansowany przez NCN (DEC-2017/01/X/NZ3/01049), kierownik projektu: dr hab. Elżbieta Ziemińska (2017-2018)
• Badanie ekspresji białka SNAP-25, analiza metabolomiczna NMR i charakterystyka behawioralna w zwierzęcych modelach autyzmu dziecięcego: odniesienie do hipotezy glutaminianowej - finansowany przez NCN (DEC-2014/15/B/NZ4/04490), kierownik projektu: prof. dr hab. Jerzy Wiesław Łazarewicz (2015-2018)
https://projekty.ncn.gov.pl/en/index.php?projekt_id=277342
• Udział niespecyficznych kanałów jonowych typu TRP przepuszczalnych dla jonów wapnia w procesach zapamiętywania i przypominania oraz ich powiązania z metabotropowymi receptorami glutaminianu grupy I. - finansowany przez NCN (DEC-2014/15/B/NZ4/04487) kierownik projektu: dr hab. Elżbieta Jolanta Salińska (2015-2018)
https://projekty.ncn.gov.pl/index.php?projekt_id=274136
Wybrane publikacje:
• Augustyniak J, Kozlowska H, Buzanska L. Genes Involved in DNA Repair and Mitophagy Protect Embryoid Bodies from the Toxic Effect of Methylmercury Chloride under Physioxia Conditions. Cells. 2023 Jan 21;12(3):390. doi: 10.3390/cells12030390.
• Beata Toczylowska , Michal Woznica , Elzbieta Zieminska , Leszek Krolicki. Metabolic Biomarkers Differentiate a Surgical Intervertebral Disc from a Nonsurgical Intervertebral Disc. Int J Mol Sci. 2023 Jun 24;24(13):10572. doi: 10.3390/ijms241310572.
• Augustyniak J, Lipka G, Kozlowska H, Caloni F, Buzanska L. Oxygen as an important factor modulating in vitro MeHgCl toxicity associated with mitochondrial genes in hiPSCs. Ecotoxicol Environ Saf. 2022 Aug;241:113737. doi: 10.1016/j.ecoenv.2022.113737.
• Bratek-Gerej E, Ziembowicz A, Salinska E. Group II Metabotropic Glutamate Receptors Reduce Apoptosis and Regulate BDNF and GDNF Levels in Hypoxic-Ischemic Injury in Neonatal Rats. Int J Mol Sci. 2022 Jun 23;23(13):7000. doi: 10.3390/ijms23137000.
• Toczylowska B, Zieminska E, Polowy R, Olszynski KH, Lazarewicz JW. NMR-Based Metabolomics of Rat Hippocampus, Serum, and Urine in Two Models of Autism. Mol Neurobiol. 2022 Sep;59(9):5452-5475. doi: 10.1007/s12035-022-02912-5
• Toczylowska B, Zieminska E, Podlecka-Pietowska A, Ruszczynska A, Chalimoniuk M. Serum metabolic profiles and metal levels of patients with multiple sclerosis and patients with neuromyelitis optica spectrum disorders - NMR spectroscopy and ICP-MS studies. Mult Scler Relat Disord. 2022 Apr;60:103672. doi: 10.1016/j.msard.2022.103672.
• Janik A, Perlińska-Lenart U, Gawarecka K, Augustyniak J, Bratek-Gerej E, Bernat P, Piłsyk S, Skalmowska P, Palamarczyk G, Swiezewska E, Kruszewska JS. Synthesis of Dolichols in Candida albicansIs Co-Regulated with Elongation of Fatty Acids. Int J Mol Sci. 2021 Dec 30;23(1):409. doi: 10.3390/ijms23010409.
• Zieminska E, Ruszczynska A, Augustyniak J, Toczylowska B, Lazarewicz JW. Zinc and Copper Brain Levels and Expression of Neurotransmitter Receptors in Two Rat ASD Models. Front Mol Neurosci. 2021 Jun 29;14:656740. doi: 10.3389/fnmol.2021.656740. eCollection 2021.
• Bratek-Gerej E, Ziembowicz A, Godlewski J, Salinska E. The Mechanism of the Neuroprotective Effect of Kynurenic Acid in the Experimental Model of Neonatal Hypoxia-Ischemia: The Link to Oxidative Stress. Antioxidants (Basel). 2021 Nov 5;10(11):1775.
doi: 10.3390/antiox10111775.
• Bratek-Gerej E, Bronisz A, Ziembowicz A, Salinska E. Pretreatment with mGluR2 or mGluR3 Agonists Reduces Apoptosis Induced by Hypoxia-Ischemia in Neonatal Rat Brains. Oxid Med Cell Longev. 2021 Mar 6;2021:8848015. doi: 10.1155/2021/8848015. eCollection 2021.
• Sowińska M, Szeliga M, Morawiak M, Ziemińska E, Zabłocka B, Urbańczyk-Lipkowska Z. Peptide Dendrimers with Non-Symmetric Bola Structure Exert Long Term Effect on Glioblastoma and Neuroblastoma Cell Lines. Biomolecules. 2021 Mar 15;11(3):435.
doi: 10.3390/biom11030435.
• Jastrzebski D, Toczylowska B, Zieminska E, Zebrowska A, Kostorz-Nosal S, Swietochowska E, Di Giulio C, Ziora D. The effects of exercise training on lipid profile in patients with sarcoidosis. Sci Rep. 2021 Mar 10;11(1):5551. doi: 10.1038/s41598-021-84815-4.
• Dutta A, Karanth SS, Bhattacharya M, Liput M, Augustyniak J, Cheung M, Stachowiak EK, Stachowiak MK. A proof of concept 'phase zero' study of neurodevelopment using brain organoid models with Vis/near-infrared spectroscopy and electrophysiology. Sci Rep. 2020 Dec 2;10(1):20987. doi: 10.1038/s41598-020-77929-8.
• Tuchalska-Czuroń J, Lenart J, Augustyniak J, Durlik M. Clinical value of tissue DNA integrity index in pancreatic cancer. Surgeon. 2020 Oct;18(5):269-279. doi: 10.1016/j.surge.2019.10.008.
• Sunderland P, Augustyniak J, Lenart J, Bużańska L, Carlessi L, Delia D, Sikora E. ATM-deficient neural precursors develop senescence phenotype with disturbances in autophagy. Mech Ageing Dev. 2020 Sep;190:111296. doi: 10.1016/j.mad.2020.111296.
• Lenart J, Augustyniak J, Lazarewicz JW, Zieminska E. Altered expression of glutamatergic and GABAergic genes in the valproic acid-induced rat model of autism: A screening test. Toxicology. 2020 Jul;440:152500. doi: 10.1016/j.tox.2020.152500.
• Graczyk S, Perlińska-Lenart U, Górka-Nieć W, Lichota R, Piłsyk S, Zembek P, Lenart J, Bernat P, Gryz E, Augustyniak J, Palamarczyk G. Kruszewska JS. Increased activity of the sterol branch of the mevalonate pathway elevates glycosylation of secretory proteins and improves antifungal properties of Trichoderma atroviride. Fungal Genet Biol. 2020 Apr;137:103334. doi: 10.1016/j.fgb.2020.103334.
• Rzemieniec J, Bratek E, Wnuk A, Przepiórska K, Salińska E, Kajta M. Neuroprotective effect of 3,3'-Diindolylmethane against perinatal asphyxia involves inhibition of the AhR and NMDA signaling and hypermethylation of specific genes.Apoptosis. 2020 Oct;25(9-10):747-762.
doi: 10.1007/s10495-020-01631-3.
• Bratek E, Ziembowicz A, Salinska E. N-Acetylaspartylglutamate (NAAG) Pretreatment Reduces Hypoxic-Ischemic Brain Damage and Oxidative Stress in Neonatal Rats. Antioxidants (Basel). 2020 Sep 17;9(9):877. doi: 10.3390/antiox9090877.
• Lenart J, Bratek E, Lazarewicz JW, Zieminska E. Changes in the Expression of SNAP-25 Protein in the Brain of Juvenile Rats in Two Models of Autism. J Mol Neurosci. 2020 Sep;70(9):1313-1320. doi: 10.1007/s12031-020-01543-6.
• Bronisz A, Rooj AK, Krawczyński K, Peruzzi P, Salińska E, Nakano I, Purow B, Chiocca EA, Godlewski J. The nuclear DICER-circular RNA complex drives the deregulation of the glioblastoma cell microRNAome. Sci Adv. 2020 Dec 16;6(51):eabc0221.
doi: 10.1126/sciadv.abc0221.
• Bronisz A, Salińska E, Chiocca EA, Godlewski J. Hypoxic Roadmap of Glioblastoma-Learning about Directions and Distances in the Brain Tumor Environment. Cancers (Basel). 2020 May 13;12(5):1213. doi: 10.3390/cancers12051213.
• Krolik A, Diamandakis D, Zych A, Stafiej A, Salinska E. The involvement of TRP channels in memory formation and task retrieval in a passive avoidance task in one-day old chicks. Neurobiol Learn Mem. 2020 May;171:107209. doi: 10.1016/j.nlm.2020.107209
• Toczylowska B, Zieminska E, Michałowska M, Chalimoniuk M, Fiszer U. Changes in the metabolic profiles of the serum and putamen in Parkinson's disease patients - In vitro and in vivo NMR spectroscopy studies. Brain Res. 2020 Dec 1;1748:147118.
doi: 10.1016/j.brainres.2020.147118.
• Toczylowska B, Zieminska E, Senator P, Lazarewicz JW. Hippocampal Metabolite Profiles in Two Rat Models of Autism: NMR-Based Metabolomics Studies. Mol Neurobiol. 2020 Jul;57(7):3089-3105. doi: 10.1007/s12035-020-01935-0.
• Augustyniak J, Bertero A, Coccini T, Baderna D, Buzanska L, Caloni F. Organoids are promising tools for species-specific in vitro toxicological studies. J Appl Toxicol. 2019 Dec;39(12):1610-1622. doi: 10.1002/jat.3815. Review.
• Augustyniak J, Lenart J, Lipka G, Stepien PP, Buzanska L. Reference Gene Validation via RT-qPCR for Human iPSC-Derived Neural Stem Cells and Neural Progenitors. Mol Neurobiol. 2019 Oct;56(10):6820-6832. doi: 10.1007/s12035-019-1538-x.
• Bertero A, Augustyniak J, Buzanska L, Caloni F. Species-specific models in toxicology: in vitro epithelial barriers. Environ Toxicol Pharmacol. 2019 Aug;70:103203. doi: 10.1016/j.etap.2019.103203. Review.
• Augustyniak J, Lenart J, Gaj P, Kolanowska M, Jazdzewski K, Stepien PP, Buzanska L. Bezafibrate Upregulates Mitochondrial Biogenesis and Influence Neural Differentiation of Human-Induced Pluripotent Stem Cells. Mol Neurobiol. 2019 Jun;56(6):4346-4363.
doi: 10.1007/s12035-018-1368-2.
• Zychowicz M, Pietrucha K, Podobinska M, Kowalska-Wlodarczyk M, Lenart J, Augustyniak J, Buzanska L. The collagen scaffold supports hiPSC-derived NSC growth and restricts hiPSC. Front Biosci (Schol Ed). 2019 Mar 1;11(1):105-121. doi: 10.2741/S529.
• Tuchalska-Czuroń J, Lenart J, Augustyniak J, Durlik M. Is mitochondrial DNA copy number a good prognostic marker in resectable pancreatic cancer? Pancreatology. 2019 Jan;19(1):73-79. doi: 10.1016/j.pan.2018.11.009.
• Flis S, Bratek E, Chojnacki T, Piskorek M, Skorski T. Simultaneous Inhibition of BCR-ABL1 Tyrosine Kinase and PAK1/2 Serine/Threonine Kinase Exerts Synergistic Effect against Chronic Myeloid Leukemia Cells. Cancers (Basel). 2019 Oct 12;11(10):1544. doi:10.3390/cancers11101544.
• Diamandakis D, Zieminska E, Siwiec M, Tokarski K, Salinska E, Lenart J, Hess G, Lazarewicz JW. Tetrabromobisphenol A-induced depolarization of rat cerebellar granule cells: ex vivo and in vitro studies. Chemosphere. 2019 May;223:64-73.
doi: 10.1016/j.chemosphere.2019.02.032.
• Ogawa D, Ansari K, Nowicki MO, Salińska E, Bronisz A, Godlewski J. MicroRNA-451 Inhibits Migration of Glioblastoma while Making It More Susceptible to Conventional Therapy. Noncoding RNA. 2019 Mar 15;5(1):25. doi: 10.3390/ncrna5010025.
• Godlewski J, Lenart J, Salinska E. MicroRNA in Brain pathology: Neurodegeneration the Other Side of the Brain Cancer. Noncoding RNA. 2019 Feb 23;5(1):20.
doi: 10.3390/ncrna5010020.
• Podlecka-Piętowska A, Kacka A, Zakrzewska-Pniewska B, Nojszewska M, Zieminska E, Chalimoniuk M, Toczylowska B. Altered Cerebrospinal Fluid Concentrations of Hydrophobic and Hydrophilic Compounds in Early Stages of Multiple Sclerosis-Metabolic Profile Analyses. J Mol Neurosci. 2019 Sep;69(1):94-105. doi: 10.1007/s12031-019-01336-6.
• Sowinska M, Morawiak M, Bochyńska-Czyż M, Lipkowski AW, Ziemińska E, Zabłocka B, Urbanczyk-Lipkowska Z. Molecular Antioxidant Properties and In Vitro Cell Toxicity of the p-Aminobenzoic Acid (PABA) Functionalized Peptide Dendrimers. Biomolecules. 2019 Mar 5;9(3):89. doi: 10.3390/biom9030089.
Zakład Komórkowej Transdukcji Sygnału
Kierownik
Prof. dr hab. n. med. Agata Adamczyk tel. 22 608 65 72, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.; pokój C-204
Sekretariat
Dorota Rycko tel. 48-22-60-86-613, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.; pokój C-209
Pracownicy naukowi
prof. dr hab. n. med. Joanna B. Strosznajder, tel.22 608 64 14, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr hab. n. med. Grzegorz A. Czapski, tel.22 608 66 00, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr hab. n. med. Magdalena Gąssowska-Dobrowolska, tel.22 608 64 20, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Anna Wilkaniec, tel.22 608 66 00, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Magdalena Cieślik, tel.22 608 64 20, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Ewelina Pałasz, tel.22 608 64 20, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
dr Gabriela Olech-Kochańczyk, tel.22 608 64 20, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr Ewelina Bielska, tel.22 608 64 13 Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Pracownicy naukowo-techniczni
mgr Elżbieta Gawinek, tel. 22 608 64 13, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Post-doc
dr Piotr Wójcik, tel. 22 608 64 13 Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Doktoranci
mgr inż. Marta Matuszewska, tel.22 6086413 Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
mgr Agnieszka Banaszek tel.22 6086413, Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Profil badawczy
Zagadnienia badawcze Zakładu koncentrują się na molekularnych mechanizmach odpowiedzialnych za rozwój zaburzeń neurorozwojowych i chorób neurodegeneracyjnych, w tym choroby Parkinsona i Alzheimera. Są to schorzenia uwarunkowane wieloczynnikowo, w patomechanizmie których istotny udział może mieć nadmierna aktywacja układu odpornościowego oraz białka o zaburzonej konformacji: α-synukleina (α-syn) i amyloid beta (Aβ). W szczególności koncentrujemy się na wyjaśnieniu zależności pomiędzy tymi czynnikami, a aktywacją komórek gleju i związanym z tym stresem oksydacyjnym oraz dysfunkcją mitochondriów, co może stanowić wspólne podłoże patologii synaps w rozwijającym się i w dojrzałym mózgu. Badania są prowadzone we współpracy z wieloma ośrodkami krajowymi i zagranicznymi, z wykorzystaniem nowoczesnych technik badawczych oraz licznych modeli eksperymentalnych o różnym poziomie złożoności, od pojedynczych komórek poprzez hodowle organotypowe in vitro i modele zwierzęce, do analizy materiału pochodzącego od pacjentów. Naszym nadrzędnym celem jest wyznaczenie nowych punktów uchwytu dla potencjalnych leków oraz zwiększenie możliwości działań terapeutycznych w chorobach ośrodkowego układu nerwowego związanych z zaburzeniami funkcjonowania synaps.
Granty
Rola receptora purynergicznego P2X7 w wywoływaniu zaburzeń metabolicznych w mózgu i w neurodegeneracji w mysim modelu choroby Parkinsona. NCN, SONATA BIS 13, 2023/50/E/NZ4/00550, 2024-2029; kierownik - dr Anna Wilkaniec
Mechanizmy zależnej od uszkodzenia mitochondriów aktywacji układu immunologicznego w eksperymentalnych modelach choroby Parkinsona. Rola zaburzeń funkcji Parkiny. NCN, OPUS 20 LAP, 2020/39/I/NZ4/01031, 2021-2025; kierownik – prof. dr hab. Agata Adamczyk
Wpływ wysiłku fizycznego na poziom czynników neurotroficznych z rodziny CDNF/MANF w mysim modelu choroby Parkinsona indukowanym domózgowym podaniem oligomerów alfa-synukleiny. NCN, MINIATURA 4, 2020/04/X/NZ4/00773, 2022-2023, kierownik - dr Ewelina Pałasz;
Rola zależnej od ATP aktywacji receptorów purynergicznych P2 w zaburzeniach energetycznych w mózgu w zwierzęcym modelu autyzmu. NCN, PRELUDIUM 20, 2021/41/N/NZ4/02350, 2022-2025; kierownik grantu - mgr inż. Lidia Babiec;
Nowa rola receptora alfa aktywowanego przez proliferatory peroksysomów w regulacji metabolizmu peptydów beta amyloidu i funkcji mitochondriów w zwierzęcym modelu choroby Alzheimera. NCN Preludium 2019/35/N/NZ4/03706, 2020-2023; kierownik - dr Sylwia Wójtowicz
Rola białek z rodziny BET w regulacji zależnych od komórek mikrogleju procesów neurodegeneracji - znaczenie w patomechanizmach choroby Alzheimera. NCN OPUS 2018/31/B/NZ4/01379, 2019-2023; kierownik – dr hab. Grzegorz A. Czapski
Znaczenie zaburzeń sygnalizacji zależnej od receptorów zewnątrzkomórkowych nukleozydów i nukleotydów w dysfunkcji synaps w autyzmie. NCN OPUS 2017/25/B/NZ4/01969, 2018-2022; kierownik – dr hab. Agata Adamczyk
Wpływ prenatalnej aktywacji układu immunologicznego na funkcje mitochondriów. NCN SONATA 2016/23/D/NZ4/03572, 2017-2021; kierownik - dr Magdalena Cieślik
Wyjaśnienie molekularnych mechanizmów leżących u podłoża połączenia jelito-mózg w zaburzeniach ze spektrum autyzmu. Zbadanie roli probiotyków w leczeniu autyzmu. SymbioPharm GmbH, Niemcy; 2018-2019; kierownik – dr hab. Agata Adamczyk,
Znaczenie kinazy sfingozyny 1 oraz sfingozyno-1-fosforanu w doświadczalnym modelu choroby Parkinsona oraz w farmakologicznej cytoprotekcji. NCN, Etiuda 4, 2016/20/T/NZ3/00504, 2016-2017; kierownik – dr Joanna A. Motyl
Znaczenie polimerazy poli(AP-rybozy) i sirtuin w regulacji śmierci komórek. Nowe punkty uchwytu w terapii choroby Alzheimera. NCN, OPUS, 2013/09//B/NZ3/01350, 2014-2017; kierownik - prof. Joanna B. Strosznajder
Udział receptorów purynergicznych P2 w dysfunkcji mitochondriów wywołanej alfa-synukleiną. Znaczenie w chorobie Parkinsona. NCN, 2013/009/D/NZ3/01359, 2014-2016; kierownik - dr Anna Wilkaniec
Rola ścieżki sygnalizacyjnej z udziałem receptorów dla sfingo-1 fosforanu (S1P) w zwierzęcym modelu choroby Parkinsona. Poszukiwanie nowych punktów uchwytu w planowaniu strategii terapeutycznych. NCN, 2013/09/N/Nz4/02045, 2014-2016; kierownik – mgr Joanna A. Pyszko
Udział Parkiny w molekularnych mechanizmach śmierci komórek wywołanej egzogenną alfa-synukleiną. Znaczenie w chorobie Parkinsona i innych synukleinopatiach. NCN, 2012/05/B/NZ3/02047, 2012-2016; kierownik - dr hab. Agata Adamczyk
Współpraca krajowa
- Warszawski Uniwersytet Medyczny; Wydział Farmaceutyczny; Zakład Farmakodynamiki - prof. dr hab. Magdalena Bujalska-Zadrożny;
- Instytut Biologii Doświadczalnej im. Marcelego Nenckiego PAN, Pracownia Metod Behawioralnych - dr Paweł Boguszewski;
- Instytut Biologii Doświadczalnej im. Marcelego Nenckiego PAN, Pracownia Molekularnych Podstaw Ruchów Komórkowych - dr hab. Krzysztof Nieznański;
- Poradnia Schorzeń Pozapiramidowych CSK MSWiA - lek. med. Kamila Bojakowska;
- Wydział Chemii Uniwersytetu Warszawskiego, Pracownia Elektrochemii – dr Marcin Strawski
- Pomorski Uniwersytet Medyczny w Szczecinie, Katedra i Zakład Biochemii i Chemii Medycznej – prof. dr hab. Irena Baranowska-Bosiacka;
- Uniwersytet Medyczny w Białymstoku - prof. dr hab. n. med. Barbara Mroczko;
Współpraca zagraniczna
- Institute of Pharmacology and Clinical Pharmacy, Biochemical and Pharmacological Center, Marburg, Germany - Prof. Carsten Culmsee;
- Louisiana State University Health Sciences Center, Department of Neurology, New Orleans, USA - Prof. Walter J. Lukiw;
- University of Missouri – Columbia (MU), Thompson Center For Autism & Neurodevelopmental Disorders, Missouri, USA - Prof. David Q. Beversdorf;
- University of Missouri, Department of Biochemistry, Columbia, USA – Prof. Grace Y. Sun;
- Institute for Pharmacy and Biochemistry, Pharmacology and Toxicology, Johannes-Gutenberg University Mainz, Mainz, Germany - Prof. Kristina Friedland;
Aparatura
- Aparatura naukowo-badawcza do analizy komórek metodą cytometrii przepływowej Becton Dickinson FACS Canto II;
- Czytnik mikropłytek Thermo Scientific Multiscan GO;
- Spektrofotometr Nanodrop 2000;
- Spektrofotometr Shimadzu UV-1700;
- Termocykler Perkin–Elmer GeneAmp PCR System 2400;
- Termocykler Eppendorf Mastercycler;
- Mikroskop fluorescencyjny odwrócony OLYMPUS IX-71;
- Licznik scyntylacyjny Wallac 1409;
- Ultrawirówka Backman LE-70;
- Aparat stereotaktyczny dla małych zwierząt RWD Life Science
- System do anestezji z niskimi przepływami SomnoSuite
Metody badawcze
- analiza zachowania myszy i szczurów w testach behawioralnych: test otwartego pola, test rozpoznawania nowego obiektu, trzykomorowy test zachowań socjalnych Crawley’a, test wokalizacji ultradźwiękowej, test podwieszonego labiryntu krzyżowego, test Rotarod, test siły uchwytu, test słupa
- hodowla komórek i bakterii in vitro
- analiza morfometryczna neurytów w komórkach in vitro
- analiza przeżywalności i obumierania komórek in vitro metodami: MTT, LDH i po barwieniu błękitem trypanu i jodkiem propidyny
- analiza apoptotycznej kondensacji chromatyny w komórkach in vitro metodą Hoechst 33342
- analiza poziomu stresu oksydacyjnego w komórkach in vitro i w mitochondriach przy użyciu sond fluorescencyjnych DCF, DAF-2 i MitoSOX
- analiza potencjału błony mitochondrialnej w komórkach in vitro metodą JC-1
- analiza poziomu ATP w komórkach in vitro metodą bioluminescencyjną
- analiza poziomu glutationu i aktywności enzymów stanu redoks metodą spektrofotometryczną
- analiza peroksydacji lipidów i oksydacji białek metodą spektrofotometryczną (TBARS, DNPH)
- analiza napływu wapnia do komórek metodą radioizotopową i FLUO-4
- oznaczanie aktywności enzymów metodą radioizotopową, spektrofotometryczną i fluorescencyjną
- analiza immunoreaktywności białek metodami Western blot, ELISA, LUMINEX, antibody array
- analiza modyfikacji potranslacyjnych białek metodą immunoprecypitacji i Western blottingu (ubikwitynacja, fosforylacja, S-nitrozylacja, poli(ADP-rybozyl)acja)
- analiza stabilności cytoszkieletu metodą elektroforetyczną z immunodetekcją α/β-tubuliny metodą Western blot
- immunohistochemia
- cytometria przepływowa
- izolacja kwasów nukleinowych (DNA, RNA, miRNA)
- analiza poziomu mRNA i miRNA metodami RT-PCR, qPCR, gene expression arrays
- analiza polimorfizmu genów metodą PCR i RFLP
- wyciszanie genów in vitro metodą siRNA
- transfekowanie komórek in vitro metodą elektroporacji i lipofekcji
- transformacja bakterii w obecności jonów Ca2+
- obrazowanie w mikroskopie fluorescencyjnym i konfokalnym komórek i tkanek
- analiza migracji komórek „scratch assay”
- analiza fagocytozy komórek z użyciem fluorescencyjnych mikrosfer
Modele badawcze in vitro:
- hodowle pierwotne neuronów kory mózgowej szczura;
- linia neuronopodobnych komórek wywodzących się z ludzkiej neuroblastomy SH-SY5Y;
- linia unieśmiertelnionych komórek ludzkiego mikrogleju C20
- ludzkie komórki śródmózgowia linii LUHMES
- linia neuronopodobnych komórek wywodzących się ze szczurzej pheochromocytomy PC12;
- linia unieśmiertelnionych neuronów z hipokampa myszy HT22;
- linia unieśmiertelnionych komórek mikrogleju myszy BV2;
- linia transfekowanych komórek PC12 cechujących się trwałą ekspresją ludzkiego genu białka prekursorowego amyloidu beta (APP) typu dzikiego;
- linia transfekowanych komórek PC12 cechujących się trwałą ekspresją ludzkiego genu białka prekursorowego amyloidu beta (APP) z podwójną mutacją szwedzką (K670M/N671L);
- linia transfekowanych komórek PC12 cechujących się trwałą ekspresją ludzkiego genu α-synukleiny (SNCA);
- linia transfekowanych komórek PC12 cechujących się trwałą ekspresją ludzkiego genu parkiny (PRKN);
Modele badawcze in vivo:
- mysi model choroby Alzheimera polegający na dokomorowym podaniu oligomerów Aβ, pozwalający na badanie ostrych efektów toksyczności Aβ;
- mysi model choroby Parkinsona polegający na podaniu α-synukleiny do prążkowia;
- model ogólnoustrojowej aktywacji układu odpornościowego u myszy i szczura polegający na dootrzewnowym podaniu lipopolisacharydu (LPS);
- szczurzy model autyzmu polegający na prenatalnej ekspozycji na kwas walproinowy (VPA) – dootrzewnowa iniekcja VPA w 12,5 dniu ciąży, badania prowadzone są na zwierzętach potomnych;
- szczurzy model zaburzeń neurorozwojowych polegający na prenatalnej ekspozycji na aktywację układu immunologicznego matki – dootrzewnowa iniekcja LPS w 9,5 dniu ciąży, badania prowadzone są na zwierzętach potomnych (model MIA - ang. Maternal Immune Activation);
- mysi model zaburzeń neurorozwojowych polegający na prenatalnej ekspozycji na aktywację układu immunologicznego matki – dootrzewnowa iniekcja kwasu poliinozyno-policytydylowego w 17 dniu ciąży, badania prowadzone są na zwierzętach potomnych (model MIA);
- myszy, u których metodą knock-outu genetycznego wyeliminowano gen parkiny; szczep B6.129S4-Prkntm1Shn/J
- myszy z nadekspresją parkiny; szczep B6;FVB-Tg(Prnp-PARK2)196Kfw/EkraJ
Wybrane publikacje
Babiec L., Wilkaniec A., Gawinek E., Hilgier W., Adamczyk A. Inhibition of purinergic P2 receptors prevents synaptic and behavioral alterations in a rodent model of autism spectrum disorders. Research in Autism Spectrum Disorders 2024, 112, 102353; https://doi.org/10.1016/j.rasd.2024.102353
Czapski GA, Matuszewska M, Cieślik M, Strosznajder JB. Inhibitor of bromodomain and extraterminal domain proteins decreases transcription of Cd33 in the brain of mice subjected to systemic inflammation; a promising strategy for neuroprotection. Folia Neuropathol. 2024;62(2):127-135. doi: 10.5114/fn.2024.138140
Ruiz-Ortega ED, Wilkaniec A, Adamczyk A. Liquid-liquid phase separation and conformational strains of α-Synuclein: implications for Parkinson's disease pathogenesis. Front Mol Neurosci. 2024 Oct 23;17:1494218. doi: 10.3389/fnmol.2024.1494218. PMID: 39507104; PMCID: PMC11537881
Gąssowska-Dobrowolska M, Olech-Kochańczyk G, Culmsee C, Adamczyk A. Novel Insights into Parkin-Mediated Mitochondrial Dysfunction and "Mito-Inflammation" in α-Synuclein Toxicity. The Role of the cGAS-STING Signalling Pathway. J Inflamm Res. 2024 Jul 11;17:4549-4574. doi: 10.2147/JIR.S468609. PMID: 39011416; PMCID: PMC11249072.
Żulińska S, Strosznajder AK, Strosznajder JB. Current View on PPAR-α and Its Relation to Neurosteroids in Alzheimer's Disease and Other Neuropsychiatric Disorders: Promising Targets in a Therapeutic Strategy. Int J Mol Sci. 2024 Jun 28;25(13):7106. doi: 10.3390/ijms25137106. PMID: 39000217; PMCID: PMC11241121
Żulińska S, Wencel PL, Czubowicz K, Strosznajder JB. Alterations in mRNA level of proteins related to redox state and mitochondria in Alzheimer’s disease animal model: Promising targets in neuroprotection Folia Neuropathol. 2024;62(3):237-247. doi: 10.5114/fn.2024.143039. PMID: 39529534
Babiec L, Wilkaniec A, Gawinek E, Hilgier W, Adamczyk A. Inhibition of purinergic P2 receptors prevents synaptic and behavioral alterations in a rodent model of autism spectrum disorders. Elsevier. Research in Autism Spectrum Disorders 112, 2024, 102353
Gąssowska-Dobrowolska M, Czapski GA, Cieślik M, Zajdel K, Frontczak-Baniewicz M, Babiec L, Adamczyk A. Microtubule Cytoskeletal Network Alterations in a Transgenic Model of Tuberous Sclerosis Complex: Relevance to Autism Spectrum Disorders. Int. J. Mol. Sci. 2023, 24, 7303. https://doi.org/10.3390/ijms24087303
Cieślik M, Zawadzka A, Czapski GA , Wilkaniec A, Adamczyk A. Developmental Stage-Dependent Changes in Mitochondrial Function in the Brain of Offspring Following Prenatal Maternal Immune Activation. Int. J. Mol. Sci. 2023, 24, 7243. https://doi.org/10.3390/ijms24087243
Palasz E, Wilkaniec A, Stanaszek L, Andrzejewska A, Adamczyk A. Glia-Neurotrophic Factor Relationships: Possible Role in Pathobiology of Neuroinflammation-Related Brain Disorders. Int J Mol Sci. 2023, 24, 6321. https://doi.org/10.3390/ijms24076321
Gąssowska-Dobrowolska M, Kolasa A, Beversdorf DQ, Adamczyk A. Alterations in Cerebellar Microtubule Cytoskeletal Network in a ValproicAcid-Induced Rat Model of Autism Spectrum Disorders. Biomedicines. 2022 Nov 24;10(12):3031. doi: 10.3390/biomedicines10123031. PMID: 36551785; PMCID: PMC9776106.
Matuszewska M, Cieślik M, Wilkaniec A, Strawski M, Czapski GA. The Role of Bromodomain and Extraterminal (BET) Proteins in Controlling the Phagocytic Activity of Microglia In Vitro: Relevance to Alzheimer's Disease. Int J Mol Sci. 2022 Dec 20;24(1):13. doi: 10.3390/ijms24010013. PMID: 36613460; PMCID: PMC9820364.
Cieślik M, Gassowska-Dobrowolska M, Zawadzka A, Frontczak-Baniewicz M, Gewartowska M, Dominiak A, Czapski GA, Adamczyk A. The Synaptic Dysregulation in Adolescent Rats Exposed to Maternal Immune Activation. Front Mol Neurosci. 2021 Jan 14;13:555290. doi: 10.3389/fnmol.2020.555290. PMID: 33519375; PMCID: PMC7840660.
Gąssowska-Dobrowolska M, Kolasa-Wołosiuk A, Cieślik M, Dominiak A, Friedland K, Adamczyk A. Alterations in Tau Protein Level and Phosphorylation State in the Brain of the Autistic-Like Rats Induced by Prenatal Exposure to Valproic Acid. Int J Mol Sci. 2021 Mar 22;22(6):3209. doi: 10.3390/ijms22063209. PMID: 33809910; PMCID: PMC8004207.
Sun GY, Appenteng MK, Li R, Woo T, Yang B, Qin C, Pan M, Cieślik M, Cui J, Fritsche KL, Gu Z, Will M, Beversdorf D, Adamczyk A, Han X, Greenlief CM. Docosahexaenoic Acid (DHA) Supplementation Alters Phospholipid Species and Lipid Peroxidation Products in Adult Mouse Brain, Heart, and Plasma. Neuromolecular Med. 2021 Mar;23(1):118-129. doi: 10.1007/s12017-020-08616-0. Epub 2020 Sep 14. PMID: 32926329; PMCID: PMC9555299.
Strosznajder AK, Wójtowicz S, Jeżyna MJ, Sun GY, Strosznajder JB. Recent Insights on the Role of PPAR-β/δ in Neuroinflammation and Neurodegeneration, and Its Potential Target for Therapy. Neuromolecular Med. 2021 Mar;23(1):86-98. doi: 10.1007/s12017-020-08629-9. Epub 2020 Nov 18. PMID: 33210212; PMCID: PMC7929960.
Motyl JA, Strosznajder JB, Wencel A, Strosznajder RP. Recent Insights into the Interplay of Alpha-Synuclein and Sphingolipid Signaling in Parkinson's Disease. Int J Mol Sci. 2021 Jun 11;22(12):6277. doi: 10.3390/ijms22126277. PMID: 34207975; PMCID: PMC8230587.
Jęśko H, Wieczorek I, Wencel PL, Gąssowska-Dobrowolska M, Lukiw WJ, Strosznajder RP. Age-Related Transcriptional Deregulation of Genes Coding Synaptic Proteins in Alzheimer's Disease Murine Model: Potential Neuroprotective Effect of Fingolimod. Front Mol Neurosci. 2021 Jul 9;14:660104. doi: 10.3389/fnmol.2021.660104. PMID: 34305524; PMCID: PMC8299068.
Wilkaniec A, Lenkiewicz AM, Babiec L, Murawska E, Jęśko HM, Cieślik M, Culmsee C, Adamczyk A. Exogenous Alpha-Synuclein Evoked Parkin Downregulation Promotes Mitochondrial Dysfunction in Neuronal Cells. Implications for Parkinson's Disease Pathology. Front Aging Neurosci. 2021 Feb 24;13:591475. doi: 10.3389/fnagi.2021.591475. PMID: 33716707; PMCID: PMC7943853.
Czapski GA, Babiec L, Jęśko H, Gąssowska-Dobrowolska M, Cieślik M, Matuszewska M, Frontczak-Baniewicz M, Zajdel K, Adamczyk A. Synaptic Alterations in a Transgenic Model of Tuberous Sclerosis Complex: Relevance to Autism Spectrum Disorders. Int J Mol Sci. 2021 Sep 17;22(18):10058. doi: 10.3390/ijms221810058. PMID: 34576223; PMCID: PMC8466868.
Czapski GA, Strosznajder JB. Glutamate and GABA in Microglia-Neuron Cross-Talk in Alzheimer's Disease. Int J Mol Sci. 2021 Oct 28;22(21):11677. doi: 10.3390/ijms222111677. PMID: 34769106; PMCID: PMC8584169.
Zawadzka A, Cieślik M, Adamczyk A. The Role of Maternal Immune Activation in the Pathogenesis of Autism: A Review of the Evidence, Proposed Mechanisms and Implications for Treatment. Int J Mol Sci. 2021 Oct 26;22(21):11516. doi: 10.3390/ijms222111516. PMID: 34768946; PMCID: PMC8584025.
Czapski GA, Cieślik M, Białopiotrowicz E, Lukiw WJ, Strosznajder JB. Down-regulation of cyclin D2 in amyloid β toxicity, inflammation, and Alzheimer's disease. PLoS One. 2021 Nov 18;16(11):e0259740. doi: 10.1371/journal.pone.0259740. PMID: 34793515; PMCID: PMC8601534.
Gąssowska-Dobrowolska M, Cieślik M, Czapski GA, Jęśko H, Frontczak-Baniewicz M, Gewartowska M, Dominiak A, Polowy R, Filipkowski RK, Babiec L, Adamczyk A. Prenatal Exposure to Valproic Acid Affects Microglia and Synaptic Ultrastructure in a Brain-Region-Specific Manner in Young-Adult Male Rats: Relevance to Autism Spectrum Disorders. Int J Mol Sci. 2020 May 18;21(10):3576. doi: 10.3390/ijms21103576. PMID: 32443651; PMCID: PMC7279050.
Jęśko H, Cieślik M, Gromadzka G, Adamczyk A. Dysfunctional proteins in neuropsychiatric disorders: From neurodegeneration to autism spectrum disorders. Neurochem Int. 2020 Dec;141:104853. doi: 10.1016/j.neuint.2020.104853. Epub 2020 Sep 24. PMID: 32980494.
Wilkaniec A, Cieślik M, Murawska E, Babiec L, Gąssowska-Dobrowolska M, Pałasz E, Jęśko H, Adamczyk A. P2X7 Receptor is Involved in Mitochondrial Dysfunction Induced by Extracellular Alpha Synuclein in Neuroblastoma SH-SY5Y Cells. Int J Mol Sci. 2020 May 31;21(11):3959. doi: 10.3390/ijms21113959. PMID: 32486485; PMCID: PMC7312811.
Cieślik M, Czapski GA, Wójtowicz S, Wieczorek I, Wencel PL, Strosznajder RP, Jaber V, Lukiw WJ, Strosznajder JB. Alterations of Transcription of Genes Coding Anti-oxidative and Mitochondria-Related Proteins in Amyloid β Toxicity: Relevance to Alzheimer's Disease. Mol Neurobiol. 2020 Mar;57(3):1374-1388. doi: 10.1007/s12035-019-01819-y. Epub 2019 Nov 16. PMID: 31734880; PMCID: PMC7061023.
Cieślik M, Gąssowska-Dobrowolska M, Jęśko H, Czapski GA, Wilkaniec A, Zawadzka A, Dominiak A, Polowy R, Filipkowski RK, Boguszewski PM, Gewartowska M, Frontczak-Baniewicz M, Sun GY, Beversdorf DQ, Adamczyk A. Maternal Immune Activation Induces Neuroinflammation and Cortical Synaptic Deficits in the Adolescent Rat Offspring. Int J Mol Sci. 2020 Jun 8;21(11):4097. doi: 10.3390/ijms21114097. PMID: 32521803; PMCID: PMC7312084.
Jęśko H, Wencel PL, Wójtowicz S, Strosznajder J, Lukiw WJ, Strosznajder RP. Fingolimod Affects Transcription of Genes Encoding Enzymes of Ceramide Metabolism in Animal Model of Alzheimer's Disease. Mol Neurobiol. 2020 Jun;57(6):2799-2811. doi: 10.1007/s12035-020-01908-3. Epub 2020 Apr 30. PMID: 32356173; PMCID: PMC7253528.
Wilkaniec A, Lenkiewicz AM, Czapski GA, Jęśko HM, Hilgier W, Brodzik R, Gąssowska-Dobrowolska M, Culmsee C, Adamczyk A. Extracellular Alpha-Synuclein Oligomers Induce Parkin S-Nitrosylation: Relevance to Sporadic Parkinson's Disease Etiopathology. Mol Neurobiol. 2019 Jan;56(1):125-140. doi: 10.1007/s12035-018-1082-0. Epub 2018 Apr 21. PMID: 29681024; PMCID: PMC6334739.
Ganjam GK, Bolte K, Matschke LA, Neitemeier S, Dolga AM, Höllerhage M, Höglinger GU, Adamczyk A, Decher N, Oertel WH, Culmsee C. Mitochondrial damage by α-synuclein causes cell death in human dopaminergic neurons. Cell Death Dis. 2019 Nov 14;10(11):865. doi: 10.1038/s41419-019-2091-2. PMID: 31727879; PMCID: PMC6856124.
Jęśko H, Lukiw WJ, Wilkaniec A, Cieślik M, Gąssowska-Dobrowolska M, Murawska E, Hilgier W, Adamczyk A. Altered Expression of Urea Cycle Enzymes in Amyloid-β Protein Precursor Overexpressing PC12 Cells and in Sporadic Alzheimer's Disease Brain. J Alzheimers Dis. 2018;62(1):279-291. doi: 10.3233/JAD-170427. PMID: 29439324.
Wilkaniec A, Gąssowska-Dobrowolska M, Strawski M, Adamczyk A, Czapski GA. Inhibition of cyclin-dependent kinase 5 affects early neuroinflammatory signalling in murine model of amyloid beta toxicity. J Neuroinflammation. 2018 Jan 4;15(1):1. doi: 10.1186/s12974-017-1027-y. PMID: 29301548; PMCID: PMC5753486.
Wilkaniec A, Gąssowska M, Czapski GA, Cieślik M, Sulkowski G, Adamczyk A. P2X7 receptor-pannexin 1 interaction mediates extracellular alpha-synuclein-induced ATP release in neuroblastoma SH-SY5Y cells. Purinergic Signal. 2017 Sep;13(3):347-361. doi: 10.1007/s11302-017-9567-2. Epub 2017 May 17. PMID: 28516276; PMCID: PMC5563296.
Czapski GA, Cieślik M, Wencel PL, Wójtowicz S, Strosznajder RP, Strosznajder JB. Inhibition of poly(ADP-ribose) polymerase-1 alters expression of mitochondria-related genes in PC12 cells: relevance to mitochondrial homeostasis in neurodegenerative disorders. Biochim Biophys Acta Mol Cell Res. 2018 Feb;1865(2):281-288. doi: 10.1016/j.bbamcr.2017.11.003. Epub 2017 Nov 8. PMID: 29128369.
Jęśko H, Wencel P, Strosznajder RP, Strosznajder JB. Sirtuins and Their Roles in Brain Aging and Neurodegenerative Disorders. Neurochem Res. 2017 Mar;42(3):876-890. doi: 10.1007/s11064-016-2110-y. Epub 2016 Nov 24. PMID: 27882448; PMCID: PMC5357501.
Jęśko H, Lenkiewicz AM, Adamczyk A. Treatments and compositions targeting α-synuclein: a patent review (2010-2016). Expert Opin Ther Pat. 2017 Apr;27(4):427-438. doi: 10.1080/13543776.2017.1261112. Epub 2016 Nov 23. PMID: 27841042.
Czapski GA, Gąssowska M, Wilkaniec A, Chalimoniuk M, Strosznajder JB, Adamczyk A. The mechanisms regulating cyclin-dependent kinase 5 in hippocampus during systemic inflammatory response: The effect on inflammatory gene expression. Neurochem Int. 2016 Feb;93:103-12. doi: 10.1016/j.neuint.2016.01.005. Epub 2016 Jan 21. PMID: 26806339.
Czapski GA, Czubowicz K, Strosznajder JB, Strosznajder RP. The Lipoxygenases: Their Regulation and Implication in Alzheimer's Disease. Neurochem Res. 2016 Feb;41(1-2):243-57. doi: 10.1007/s11064-015-1776-x. Epub 2015 Dec 16. PMID: 26677076; PMCID: PMC4773476.
Gąssowska M, Baranowska-Bosiacka I, Moczydłowska J, Tarnowski M, Pilutin A, Gutowska I, Strużyńska L, Chlubek D, Adamczyk A. Perinatal exposure to lead (Pb) promotes Tau phosphorylation in the rat brain in a GSK-3β and CDK5 dependent manner: Relevance to neurological disorders. Toxicology. 2016 Mar 10;347-349:17-28. doi: 10.1016/j.tox.2016.03.002. Epub 2016 Mar 21. PMID: 27012722.
Jęśko H, Wilkaniec A, Cieślik M, Hilgier W, Gąssowska M, Lukiw WJ, Adamczyk A. Altered Arginine Metabolism in Cells Transfected with Human Wild-Type Beta Amyloid Precursor Protein (βAPP). Curr Alzheimer Res. 2016;13(9):1030-9. doi: 10.2174/1567205013666160314150348. PMID: 26971935.
Gąssowska M, Baranowska-Bosiacka I, Moczydłowska J, Frontczak-Baniewicz M, Gewartowska M, Strużyńska L, Gutowska I, Chlubek D, Adamczyk A. Perinatal exposure to lead (Pb) induces ultrastructural and molecular alterations in synapses of rat offspring. Toxicology. 2016 Dec 12;373:13-29. doi: 10.1016/j.tox.2016.10.014. Epub 2016 Oct 29. PMID: 27974193.
Wilkaniec A, Czapski GA, Adamczyk A. Cdk5 at crossroads of protein oligomerization in neurodegenerative diseases: facts and hypotheses. J Neurochem. 2016 Jan;136(2):222-33. doi: 10.1111/jnc.13365. Epub 2015 Oct 14. PMID: 26376455.